
【题目】有机物A是烃,有机物B易溶于水,且1 mol B能跟足量的钠反应生成标准状况下的H2 11.2 L,但不能与NaHCO3溶液反应,已知A通过如下转化关系可制得化学式为C4H8O2的酯E,且当D―→E时,相对分子质量增加28。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)反应①的原子利用率为________。
(2)B的密度比水________,B中含氧官能团的名称为________。
(3)反应②的化学方程式为________________________________。
(4)反应③的反应类型为______________________。
(5)4.4 g C物质完全燃烧消耗________ mol氧气。
(6)若D―→E时,式量增加m,则B的相对分子质量为__________ (用含m的代数式表示) 。
【答案】 100% 小 羟基 ![]() 取代反应(或酯化反应) 0.25 m+18
取代反应(或酯化反应) 0.25 m+18
【解析】有机物B易溶于水,且1molB能与足量的钠反应生成标准状况下的H211.2L,氢气为0.5mol,但不与NaHCO3溶液反应,故B分子含有1个-OH,D与B反应得到酯E的分子式为C4H8O2,属于饱和一元酯,由转化关系可知A、B、C、D分子中含有碳原子数目相等,结合E的分子式可知,A、B、C、D分子中均含有2个含有碳原子,故B为CH3CH2OH,烃A与水发生加成反应生成乙醇,A为CH2=CH2,B发生氧化反应生成C为CH3CHO,C反应氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,则
(1)反应①是乙烯与水发生加成反应生成乙醇,原子利用率为100%;(2)B为乙醇,密度比水小,B中含氧官能团的名称为:羟基;(3)反应②是乙醇发生催化氧化生成乙醛,反应化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(4)反应③是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应;(5)4.4g C(乙醛)的物质的量为4.4g÷44g/mol=0.1mol,完全燃烧消耗氧气为0.1mol×(2+4/4-1/2)=0.25mol;(6)若D→E时是乙酸与醇转化生成酯,式量增加m,根据质量守恒定律,Mr(D)+Mr(B)=Mr(D)+Mr(水),则Mr(B)=Mr(D)-Mr(D)++Mr(水)=m+18。
2CH3CHO+2H2O;(4)反应③是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应;(5)4.4g C(乙醛)的物质的量为4.4g÷44g/mol=0.1mol,完全燃烧消耗氧气为0.1mol×(2+4/4-1/2)=0.25mol;(6)若D→E时是乙酸与醇转化生成酯,式量增加m,根据质量守恒定律,Mr(D)+Mr(B)=Mr(D)+Mr(水),则Mr(B)=Mr(D)-Mr(D)++Mr(水)=m+18。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的描述正确的是( )
A. 有7个周期,18个族
B. 第IA族元素也称为碱金属元素
C. 元素种类最多的族为第IIIB族
D. 第七周期若排满,最多可排50种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有(不考虑立体异构) ( )
A. 15种 B. 14种 C. 13种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品.一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如下:
![]()
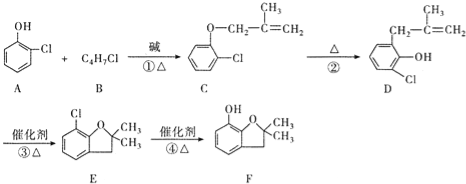
回答下列问题:
(1)A 物质核磁共振氢谱共有 个峰,④的反应类型是 ,C和D中含有的相同官能团的名称是 .
(2)下列试剂中,能和D反应的有 (填标号).
A.溴水 B.酸性K2Cr2O7溶液 C.FeC12溶液 D.纯碱溶液
(3)写出反应①的化学方程式是 (有机物用结构简式表示,下同).
(4)有机物B可由异丁烷经三步反应合成:异丁烷![]() X
X![]() Y
Y![]()
![]() 有机物B条件a为 ,Y生成B的化学方程式为 .
有机物B条件a为 ,Y生成B的化学方程式为 .
(5)呋喃酚的同分异构体很多,写出符合下列条件的所有同分异构体的结构简式
①苯环上的一氯代物只有一种
②能发生银镜反应的芳香酯.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液的化学方程式:__________________________。
(2)锌和氢氧化钠溶液反应后,溶液中锌元素的存在形式为_________(用化学式表示)。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是_______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:__________。
(5)某混合物![]() ,含有
,含有![]() 、
、![]() 和
和![]() ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
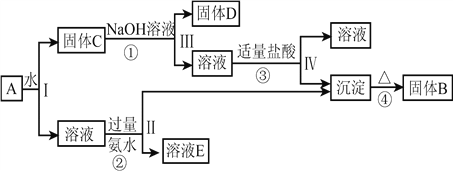
据此回答下列问题:
①写出固体![]() 的化学式:
的化学式: ![]() __________;
__________;
②写出D与稀硫酸反应的化学方程式:___________________________________________;
写出反应①的离子方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g Fe、Mg合金溶解在一定量的稀硝酸中,当合金完全溶解后,收集到标准状况下的NO气体b L(设HNO3的还原产物只有NO)。再向反应后的溶液中加入足量NaOH溶液,得到沉淀物。若用守恒法求沉淀的质量,用到的守恒关系依次是
A. 质量守恒、电子守恒、电荷守恒 B. 电子守恒、质量守恒、电荷守恒
C. 电子守恒、电荷守恒、质量守恒 D. 电荷守恒、质量守恒、电子守恒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:

(1)a仪器的名称为_______;A装置中反应的化学方程式为_______。
(2)试剂b为_______;C装置的作用为_______。
(3)所用d导管较粗的原因是_______;E装置的作用为_______。
(4)F装置的作用为_______。
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_______;用离子方程式表示E中的现象变化_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固态氯化钠中混有的氯化钙。请根据如下实验方案回答相关问题:
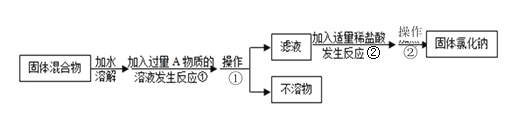
(1)操作①所需主要玻璃仪器有_________________________
(2)反应①中加入略过量的A物质的目的是______________________;判断A已过量的实验操作方法是_______________________________________________;反应①的化学反应方程式为___________________________________________________。
(3)操作②的名称为__________________;反应②的离子方程式______________________。
(4)实验时称取样品质量为185.0g,经过操作①后,经洗涤、干燥后测得沉淀质量为50.0g,则样品中NaCl的质量百分数为_________________________。(保留到小数点后第一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙是电化学实验装置:
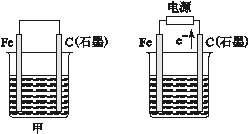 乙
乙
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________________。
②乙中总反应的离子方程式为___________________________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_____。
(2))若甲、乙两烧杯中均盛有CuSO4溶液:
①甲中铁棒上的电极反应式为___________________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_____________________(填写物质的化学式)______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com