
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.36g冰中含有氢键的数目为2NA
B.100g30%的甲醛水溶液中所含的氧原子数目为1NA
C.1molCl2与足量铁粉完全燃烧,转移的电子数为3NA
D.14gFe发生电化学腐蚀最终生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
【答案】D
【解析】
A.如图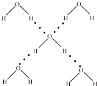 ,每摩尔水分子都和4个水分子形成氢键,而每个氢键被两个水分子共有,所以1mol水能够形成2mol氢键,所以36g冰中含有氢键的数目最多为4NA,故A错误;
,每摩尔水分子都和4个水分子形成氢键,而每个氢键被两个水分子共有,所以1mol水能够形成2mol氢键,所以36g冰中含有氢键的数目最多为4NA,故A错误;
B.甲醛和水分子中均含有氧原子,100g30%的甲醛水溶液中所含的氧原子数目多于1NA,故B错误;
C.1molCl2与足量铁粉完全燃烧,生成物中氯显-1价,转移的电子数为2NA,故C错误;
D.14g铁的物质的量为n=![]() =0.25mol,而铁反应生成Fe2O3·xH2O后,铁的价态由0价变为+3价,但0.25mol铁的电极反应为Fe-2e-=Fe2+,电极反应转移的电子数为0.5NA,故D正确;
=0.25mol,而铁反应生成Fe2O3·xH2O后,铁的价态由0价变为+3价,但0.25mol铁的电极反应为Fe-2e-=Fe2+,电极反应转移的电子数为0.5NA,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】研究来源于真菌的天然产物L的合成对抗肿瘤药物研发有着重要意义,其合成路线主要分为两个阶段:
I.合成中间体F

已知:ⅰ.TBSCl为![]()
ⅱ. 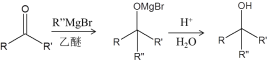
(1)A中含氧官能团名称__________。
(2)B的结构简式是__________。
(3)试剂a是__________。
(4)TBSCl的作用是__________。
II. 合成有机物L

已知: ![]()
(5)H中含有两个酯基,H的结构简式是__________。
(6)I→J的反应方程式是__________。
(7)K→L的转化中,两步反应的反应类型依次是__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁氧化合物循环分解水制H2
已知:H2O(l)===H2(g)+![]() O2(g) ΔH1=+285.5 kJ/mol
O2(g) ΔH1=+285.5 kJ/mol
6FeO(s)+O2(g) ===2Fe3O4(s) ΔH2=-313.2 kJ/mol
则:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH3=___________
(2)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为: 3CH4(g) + Fe2O3(s) ![]() 2Fe(s) +6H2(g) +3CO(g) ΔH4
2Fe(s) +6H2(g) +3CO(g) ΔH4
①此反应的化学平衡常数表达式为_________________________________。
②在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入amolCO和2a molH2,三个容器的反应温度分别保持T1、T2、T3,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是___________(选填“Ⅰ”“Ⅱ”或“Ⅲ”);制备“纳米级”金属铁的反应:ΔH4 _____ 0(填“>”或“<”)。
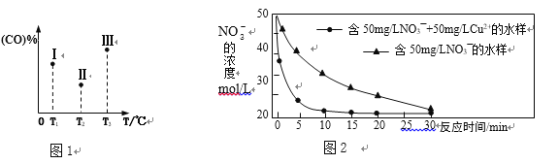
③在T℃下,向某恒容密闭容器中加入3molCH4(g)和2mol Fe2O3(s)进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。10 min内用Fe2O3(s)表示的平均反应速率为_______g·min-1; T℃下该反应的Kp = _____________________;T℃下若起始时向该容器中加入2molCH4(g)、4mol Fe2O3(s)、1molFe(s)、2mol H2(g)、2molCO(g),则起始时v (正)______v (逆) (填“>”、“<”或“=”)。
(3)纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O
①研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是_________________。
②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,图2中所产生的差异的可能原因是__________________________________________________(答一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。
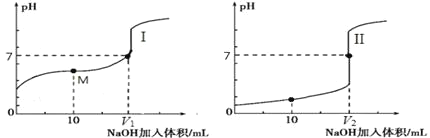
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
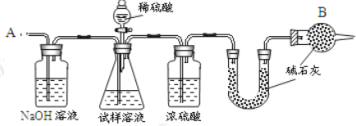
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是世界上最大的钨储藏国,超细钨粉是生产硬质合金所必须的原料。
(1)工业上可以采用铝热还原法生产钨铁合金,已知:
①WO3(s)+2Al(s)=W(s)+Al2O3(s) H1
②3Fe3O4(s)+8Al(s)=9Fe(s)+4Al2O3(s) H2
则四氧化三铁与钨反应的热化学方程式为___(反应热写为H3并用含△H1、AH2的代数式表示);在反应②中若有0.1molFe3O4参加反应,则转移电子___mol。
(2)自然界中钨主要存在于黑钨矿中(主要成分是铁和锰的钨酸盐),从中制备出黄钨(WO3)后再用H2逐级还原:WO3→WO2.90→WO2.72→WO2→W,总反应为3H2(g)+WO3(s)![]() W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
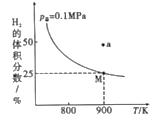
①由图可知,该反应的H____(填“>”或“<”)0;a点处的v正___v逆(填“>”“<”或“=”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是__(填序号)。
A.v正(H2)=v逆(H2O)
B.加入WO3,则H2的转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知900K,氢气的平衡转化率为__,Kp(900K)=____(用平衡分压代替平衡浓度计算,已知:平衡分压=p总×气体物质的量分数)。
④已知在高温下,氧化钨会与水蒸气反应生成一种挥发性极强的水钨化合物WO2(OH)2,因此在反应中要适当加快氢气的流速,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下 1mol 某纯物质的热效应,单位常用 kJ/mol表示,已知在 25℃的条件下:
①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol
②2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=-30.56kJ/mol
O2(g)═Ag2O(s)△H=-30.56kJ/mol
③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=-92.21 kJ/mol
Cl2(g)═HCl(g)△H=-92.21 kJ/mol
④H2(g)+ ![]() O2(g)═H2O(l)△H=-285.6 kJ/mol
O2(g)═H2O(l)△H=-285.6 kJ/mol
则25℃时氯化银的标准生成热为________ kJ/mol;
(2)实验测得 64g 甲醇[CH3OH(l)]在氧气中充分燃烧生成 CO2 气体和液态水时放出 1452.8kJ 的热量,则表示甲醇燃烧热的热化学方程式_________________;
(3)以甲烷、氧气为原料,KOH 为电解质,构成燃料电池,写出其负极的电极反应式:________;
(4)电解法制取有广泛用途的 Na2FeO4,工作原理如下图所示。
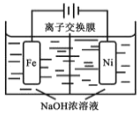
已知:Na2FeO4 只在强碱性条件下稳定。
①Na2FeO4能够净水的主要原因是_______________ 。
②阳极电极反应式 _______________;
③为使电解能较持久进行,应选用_______________ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.乙酸和甲醛分别完全燃烧,若消耗的氧气量一样,则它们的质量相等
B.通过核磁共振氢谱可以区分CH3 CH2CH2OH和![]()
C.莽草酸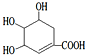 可以发生氧化、还原、酯化、加聚反应
可以发生氧化、还原、酯化、加聚反应
D.Cl2与甲苯在光照条件下反应,苯环上的氢原子被取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示,下列说法中正确的是( )

A.分子式为C17H18O3
B.M中所有碳原子均可能在同一平面
C.1mol M最多可以与3 mol NaOH反应
D.M可以发生加成、取代、消去等反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com