
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO=2Fe3O4+CO2 Fe3O4+CO=3FeO+CO2 FeO+CO=Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物。则此固体成分和它们的物质的量之比可能的是
A.n(FeO):n(Fe3O4)=1∶1B.n(Fe2O3):n(FeO)=2∶1
C.n(Fe2O3):n(FeO)=1∶2D.n(Fe2O3):n(Fe3O4)=1∶1
【答案】AC
【解析】
反应中CO~CO2,固体质量减少为CO获得的氧原子质量,根据固体质量差计算减少O原子,根据守恒法计算反应后氧原子物质的量,反应中Fe原子物质的量不变,可以确定反应后氧化物中Fe、O原子数目之比,结合选项判断。
固体质量减少为CO获得的氧原子质量,根据固体质量差,可知减少O原子质量为4.8g4.56g=0.24g,减少O原子物质的量为![]() =0.015mol,氧化铁的物质的量为
=0.015mol,氧化铁的物质的量为![]() =0.03mol,则反应后氧化物中O原子物质的量为0.03moL×30.015mol=0.075mol,反应中Fe原子物质的量不变,则反应后氧化物中Fe、O原子数目之比为0.03mol×2:0.075mol=4:5。
=0.03mol,则反应后氧化物中O原子物质的量为0.03moL×30.015mol=0.075mol,反应中Fe原子物质的量不变,则反应后氧化物中Fe、O原子数目之比为0.03mol×2:0.075mol=4:5。
A. 当n(FeO):n(Fe3O4)=1:1,则Fe、O原子数目之比为(1+3):(1+4)=4:5,故A正确;
B. 当n(Fe2O3):n(FeO)=2:1,则Fe、O原子数目之比为(2×2+1):(3×2+1)=5:7,故B错误;
C. 当n(Fe2O3):n(FeO)=1:2,则Fe、O原子数目之比为(2+1×2):(3+1×2)=4:5,故C正确;
D.当n(Fe2O3):n(Fe3O4)=1:1,则Fe、O原子数目之比为(2+3):(3+4)=5:7,故D错误;
答案选AC。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )
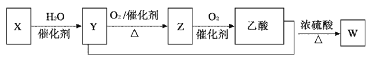
A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
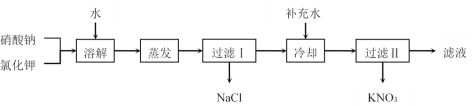
【题目】I.硝酸钾用途广泛,工业上一般用复分解反应制取硝酸钾(相关物质的溶解度曲线见表)。以硝酸钠和氯化钾为原料制备硝酸钾的工艺流程如下:

完成下列填空:
(1)为了加速固体溶解,可采取的措施有__________(至少写两种);实验室进行蒸发结晶操作时,为了防止液滴飞溅,进行的操作是_____________。
(2)过滤I所得滤液中含有的离子是________;过滤I所得滤液在进行冷却结晶前应补充少量水,目的是______________。
(3)检验产品KNO3中杂质的方法是________________。
II.实验室模拟工业上用氯化钾和硝酸铵为原料制取硝酸钾的过程如下:
取40 g NH4NO3和37.25 g KCl固体加入100 g水中,加热至90℃,固体溶解, 用冰水浴冷却至5℃以下,过滤(a)。在滤液中再加入NH4NO3,加热蒸发,当体积减小到约原来的![]() 时,保持70℃过滤(b),滤液可循环使用。完成下列填空:
时,保持70℃过滤(b),滤液可循环使用。完成下列填空:
(4)过滤(a)得到的固体物质主要是__________;在滤液中再加入NH4NO3的目的是________________________。
(5)为检测硝酸钾样品中铵盐含量,称取1.564 g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00 mL 0.102 mol/L H2SO4溶液全部吸收,滴定过量的H2SO4用去0.089 mol/L标准NaOH溶液16.55 mL。滴定过程中使用的指示剂是________;样品中含铵盐(以氯化铵计)的质量分数是___________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)单质化学性质最不活泼的是___;
(2)地壳中含量最多的元素是___(填名称);
(3)单质常用作半导体材料的是___;
(4)Mg原子结构示意图为___;
(5)O和S中,原子半径较大的是___;
(6)CH4和NH3中,热稳定性较强的是___(填名称);
(7)新制氯水有漂白作用,是因为其中含有___(填“HCl”或“HClO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),两性氢氧化物是___;
(9)某烃分子中含有6个碳原子,结构简式为![]() ,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O![]() 2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
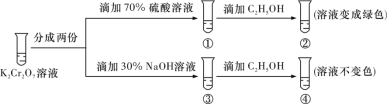
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图。
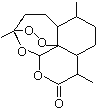
(1)青蒿素的分子式为________________________。
(2)为了引入过氧基![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)天然香草醛(![]() )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
![]()
(4)步骤①③的作用是_________________________________________________________________________________。
(5)C8H10O3的结构简式:__________________________________________________________。
(6)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式_________________。
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应。
(7)苄基乙醛![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
已知:羰基α-H可发生反应:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料可以合成多种高聚物的合成路线如下:
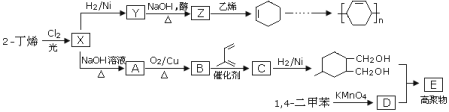
已知:烯烃和X2在一定条件下能发生取代,且能发生双烯合成如![]() 。
。
请回答下列问题:
(1)X中含有的官能团为_____________________________________;
(2)Y→Z的化学方程式为_____________________________;
(3)高聚物E的结构简式为____________________________;甲是A的一种同分异构体,其能实现转化:![]() ,甲的名称为________;
,甲的名称为________;
(4)由![]() 可以合成
可以合成![]() 。按合成路线的顺序,涉及反应的反应类型有:______________。
。按合成路线的顺序,涉及反应的反应类型有:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验。完成下列填空:
甲用重量法确定CO2的质量,装置如下图:
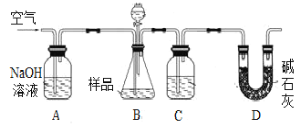
(1)B中反应的化学方程式为____________________________________________________。
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为___________________________________________________________。
(3)不能提高测定精确度的措施是___________。
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
乙用滴定法确定CO2的物质的量,将样品配制成100mL溶液,从中取出20.00 mL,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当______________________________________________________时,停止滴定。平行测定三次,有关实验数据记录如下表。m1 g样品产生CO2的物质的量为_____________。
实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
初读数 | 末读数 | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
丙用气体体积法确定CO2的体积,装置如图所示。

(4)为了减小实验误差,量气管中加入的液体X为___________________溶液;
(5)若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是____________________________________________________________________________。
(6)确定CO2的相对分子质量,选用___________________(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25 |
|
|
|
下列选项错误的是( )
A.CN + H2O + CO2 → HCN +HCO3﹣
B.2HCOOH + CO32﹣ → 2HCOO + H2O + CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com