
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O![]() 2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
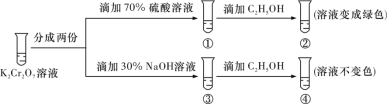
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水生产过程中,可用氯气等物质作消毒剂,明矾等物质作絮凝剂。出厂的自来水中含少量可溶性矿物质。完成下列填空:
(1)自来水中含硫量约70 mg/L,它只能以______(填微粒符号)形态存在,不能以其它形态存在的原因是________________________。
(2)已知在碱性条件下,氯气会发生自身氧化还原反应,某反应体系中的物质为:KClO3、Cl2、KCl、KOH、H2O。
①写出该反应的化学方程式。____________________________。
②该反应中氧化剂与还原剂的质量比为_________。
(3)实验室利用反应6HCl+KClO3 → KCl+3H2O+3Cl2↑制取Cl2,当产生标准状况下的气体3.36 L时,转移电子_____mol。
(4)不同环境中,物质的性质可能会有所不同。根据上述两题的反应中KClO3和Cl2的氧化性强弱比较,你能得出的结论是________________________。
(5)铝铵矾[NH4Al(SO4)212H2O]也是常用的工业净水剂,其净水的化学原理是________________(用离子方程式表示)。
(6)在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确的是_________。(选填编号)
a.n(SO42-)>n(NH4+)>n(A13+)>n(OH-)
b.n(A13+)>n(NH4+)>n(SO42-)>n(H+)
c.n(BaSO4)>n[A1(OH)3]>n(NH3·H2O)>n(A1O2-)
d.n(NH3·H2O)>n(BaSO4)>n[A1(OH)3]>n(A1O2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为周期表中短周期的一部分,若R原子核外有3个未成对电子,说法正确的是

A.原子半径大小顺序是:Y>X>R
B.其气态氢化物的稳定性顺序是:Z>Y>X>R
C.X、Y、Z中Z的氧化物对应的水化物的酸性最强
D.R的气态氢化物与它的含氧酸之间能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
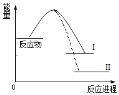
A.1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热
B.N2(g)+3H2(g)![]() 2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO=2Fe3O4+CO2 Fe3O4+CO=3FeO+CO2 FeO+CO=Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物。则此固体成分和它们的物质的量之比可能的是
A.n(FeO):n(Fe3O4)=1∶1B.n(Fe2O3):n(FeO)=2∶1
C.n(Fe2O3):n(FeO)=1∶2D.n(Fe2O3):n(Fe3O4)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
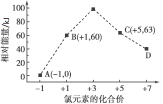
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,则H2的燃烧热ΔH=-572kJ·mol-1
B.一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1,此条件下将1.5mol H2和过量N2充分反应,放出热量46.2kJ
2NH3(g) ΔH=-92.4kJ·mol-1,此条件下将1.5mol H2和过量N2充分反应,放出热量46.2kJ
C.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D.已知:2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
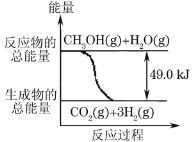
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g) -49.0kJ
②CH3OH(g)+![]() O2(g)→CO2(g)+2H2(g)+192.9kJ
O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.1molCH3OH完全燃烧放热192.9kJ
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+![]() O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com