
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
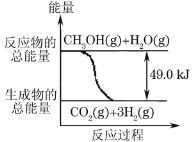
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g) -49.0kJ
②CH3OH(g)+![]() O2(g)→CO2(g)+2H2(g)+192.9kJ
O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.1molCH3OH完全燃烧放热192.9kJ
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+![]() O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
【答案】D
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,即H元素要转化为液态水而不是转化为氢气,故1molCH3OH完全燃烧放出的热量不是192.9kJ,故A错误;
B.因为①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的Q小于0,该反应是吸热反应,所以反应物的总能量应该小于生成物的总能量,故B错误;
C.②中的热化学方程式表明,CH3OH转变成H2的过程不一定要吸收能量,故C错误;
D.因为CH3OH(l)变成CH3OH(g)需要吸收能量,根据②推知反应:CH3OH(l)+![]() O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ,故D正确;
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O![]() 2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
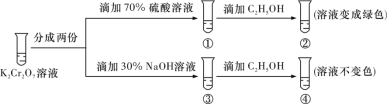
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下达平衡后,增大压强平衡不移动
B.该反应方程式可表示为:X+2Y=3W
C.升高温度,若W的体积分数减小,则此反应ΔH>0
D.恒温恒容时,增加X的物质的量,平衡向正向移动,X的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.已知t1℃时,反应C+CO2![]() 2CO △H>0的速率为υ,若升高温度,逆反应速率减小
2CO △H>0的速率为υ,若升高温度,逆反应速率减小
B.恒压容器中发生反应N2+O2![]() 2NO,若在容器中充入He,正逆反应速率均不变
2NO,若在容器中充入He,正逆反应速率均不变
C.当一定量的锌粉和过量的6molL1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入少量的CuSO4溶液
D.待反应PCl5(g)![]() PCl3(g)+Cl2(g) 达到平衡后,保持温度和体积不变,再充PCl5(g)达到新的平衡,新平衡和原平衡相比PCl5(g)的转化率减少
PCl3(g)+Cl2(g) 达到平衡后,保持温度和体积不变,再充PCl5(g)达到新的平衡,新平衡和原平衡相比PCl5(g)的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某烃分子的相对分子量为28,一定体积的该烃完全燃烧生成4.48LCO2和3.6g水,该烃的分子式_________________。
(2)顺-1,2-二溴乙烯结构式_________________。
(3)2-丁烯与HCl的加成方程式_______________________________________。
(4)![]() 的系统命名为________________。
的系统命名为________________。
(5)按要求回答下列问题:
合成芳香炔化合物的方法之一是在催化条件下,含炔氢的分子与溴苯发生反应,如:
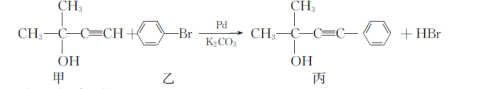
根据上式,请回答:
①丙能发生的反应是__________ (选填字母)。
a.取代反应 b.加成反应 c.水解反应 d.消去反应
②甲中含有的官能团名称为__________。
③符合下列条件的丙的同分异构体有__________种(不包括顺反异构)。
a分子中除苯环外不含其他环状结构;
b苯环上只有2个取代基,且其中一个是醛基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25 |
|
|
|
下列选项错误的是( )
A.CN + H2O + CO2 → HCN +HCO3﹣
B.2HCOOH + CO32﹣ → 2HCOO + H2O + CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
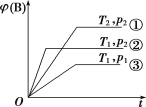
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1<T2,p1>p2,m+n<p,吸热反应
C.T1>T2,p1<p2,m+n<p,吸热反应
D.T1>T2,p1<p2,m+n>p,放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:反应Ⅰ: aTiO2+bCl2+cC ![]() aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg
aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg![]() Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
A.反应Ⅰ中的TiO2是氧化剂
B.TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com