
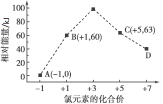
【题目】一定条件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,关于a g亚硫酸钠晶体(Na2SO37H2O)的说法中正确的是
A.含Na+数目为![]() NAB.含氧原子数目为
NAB.含氧原子数目为![]() NA
NA
C.完全氧化SO32-时转移电子数目为![]() NAD.含结晶水分子数目为
NAD.含结晶水分子数目为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O![]() 2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
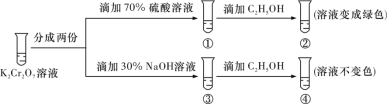
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备时目前的研究热点。某工艺利用电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2.下列有关描述不合理的是
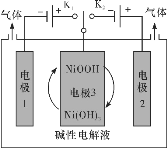
A.制H2时,产生H2的电极反应式:2H2O+2e-=H2↑+2OH-
B.制O2时,电极3要连接K2
C.若没有电极3,K1和K2直接相连,一样可以得到H2和O2
D.上述过程,若用酸性电解质一样可以实现上述过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料可以合成多种高聚物的合成路线如下:
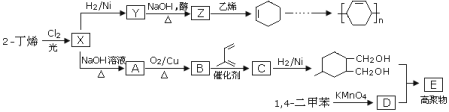
已知:烯烃和X2在一定条件下能发生取代,且能发生双烯合成如![]() 。
。
请回答下列问题:
(1)X中含有的官能团为_____________________________________;
(2)Y→Z的化学方程式为_____________________________;
(3)高聚物E的结构简式为____________________________;甲是A的一种同分异构体,其能实现转化:![]() ,甲的名称为________;
,甲的名称为________;
(4)由![]() 可以合成
可以合成![]() 。按合成路线的顺序,涉及反应的反应类型有:______________。
。按合成路线的顺序,涉及反应的反应类型有:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260 g草酸晶体,配成100 mL溶液。
②取25.00 mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000 mol/L的KMnO4溶液滴定H2C2O4溶液,当__________________时,滴定结束。
④记录数据,重复实验。整理数据如:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 11.50 |
回答下列问题:
(1)步骤①需使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为______________(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为_______________(填名称)。
(2)该反应原理的化学方程式为_____________________________________________。
(3)请将步骤③补充完整_____________________________________________________。
(4)根据数据,计算H2C2O4溶液的物质的量浓度为_________mol/L,x=________。
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会_________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下达平衡后,增大压强平衡不移动
B.该反应方程式可表示为:X+2Y=3W
C.升高温度,若W的体积分数减小,则此反应ΔH>0
D.恒温恒容时,增加X的物质的量,平衡向正向移动,X的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com