
【题目】NA为阿伏加德罗常数,关于a g亚硫酸钠晶体(Na2SO37H2O)的说法中正确的是
A.含Na+数目为![]() NAB.含氧原子数目为
NAB.含氧原子数目为![]() NA
NA
C.完全氧化SO32-时转移电子数目为![]() NAD.含结晶水分子数目为
NAD.含结晶水分子数目为![]() NA
NA
【答案】D
【解析】
A. a g亚硫酸钠晶体(Na2SO37H2O)的物质的量n=![]() mol,而1 mol Na2SO37H2O中含2molNa+,故
mol,而1 mol Na2SO37H2O中含2molNa+,故![]() mol Na2SO37H2O中含
mol Na2SO37H2O中含![]() mol,即
mol,即![]() mol钠离子,A错误;
mol钠离子,A错误;
B. a g亚硫酸钠晶体(Na2SO37H2O)的物质的量n=![]() mol,而1 mol Na2SO37H2O中含10 mol氧原子,故
mol,而1 mol Na2SO37H2O中含10 mol氧原子,故![]() mol Na2SO37H2O中含氧原子
mol Na2SO37H2O中含氧原子![]() mol,即含有
mol,即含有![]() mol的O原子,B错误;
mol的O原子,B错误;
C. SO32-被氧化时,由+4价被氧化为+6价,即1 mol SO32-转移2 mol电子,故![]() mol Na2SO37H2O转移
mol Na2SO37H2O转移![]() mol 电子,C错误;
mol 电子,C错误;
D. 1 mol Na2SO37H2O中含7 mol水分子,故![]() mol Na2SO37H2O中含水分子数目为
mol Na2SO37H2O中含水分子数目为![]() mol×7×NA/mol=
mol×7×NA/mol=![]() NA,D正确;
NA,D正确;
故合理选项是D。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】煅烧黄铁矿(主要成分为FeS2)所得的矿渣中含Fe2O3、SiO2、Al2O3、MgO等.用该矿渣可制备铁红(Fe2O3).完成下列填空:
(1)煅烧黄铁矿的化学方程式____,反应过程中被氧化的元素____.
(2)矿渣中属于两性氧化物的是___,写出Fe2O3与稀硫酸反应的离子方程式__.
(3)Al(OH)3的碱性比Mg(OH)2的碱性___(选填“强”或“弱”);铝原子最外层电子排布式为____.
(4)SiO2的熔点___ Fe2O3的熔点(填“大于”或“小于”),原因是__.
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为______(用表达式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.![]() 和CO的混合物共
和CO的混合物共![]() ,其中碳原子的数目为NA
,其中碳原子的数目为NA
B.![]() 重水
重水![]() 分子中含有的中子数为0.8NA
分子中含有的中子数为0.8NA
C.![]() 放入过量的98%浓
放入过量的98%浓![]() 中,转移电子数为3NA
中,转移电子数为3NA
D.![]()
![]() 的NaCl溶液中微粒数大于0.5NA
的NaCl溶液中微粒数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,各地媒体纷纷报道了有“火锅红”、“火锅飘香剂”、“辣椒精”等造就的“化学火锅”的新闻,食品添加剂的使用引起了人们的注意,亟待规范。
乙偶姻是一种应用较广泛的香料.乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,乙偶姻中含有碳氧双键.与乙偶姻有关的反应如下:
已知:HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO
RCHO+R’CHO
(1)乙偶姻的分子式为__,G的结构简式为__;
(2)反应①、②的反应类型为:①__、②__;
(3)D→E反应的化学方程式为________________;
B→C反应的化学方程式为___________________;
(4)X是乙偶姻的同分异构体,属于酯类,写出2种X可能的结构简式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2CO3的电离常数:K1=4.4×10-7,K2=4.7×10-11,HClO的电离常数:2.95×10-8。反应:Cl2+H2O![]() HCl+HClO达到平衡后,要使c(HClO)增大可加入( )
HCl+HClO达到平衡后,要使c(HClO)增大可加入( )
A.NaOHB.HClC.CaCO3(固体)D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)![]() 3B(?)+C(?) ΔH>0,随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
3B(?)+C(?) ΔH>0,随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
A.B和C可能都是固体B.B和C一定都是气体
C.若C为固体,则B一定是气体D.B和C一定都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水生产过程中,可用氯气等物质作消毒剂,明矾等物质作絮凝剂。出厂的自来水中含少量可溶性矿物质。完成下列填空:
(1)自来水中含硫量约70 mg/L,它只能以______(填微粒符号)形态存在,不能以其它形态存在的原因是________________________。
(2)已知在碱性条件下,氯气会发生自身氧化还原反应,某反应体系中的物质为:KClO3、Cl2、KCl、KOH、H2O。
①写出该反应的化学方程式。____________________________。
②该反应中氧化剂与还原剂的质量比为_________。
(3)实验室利用反应6HCl+KClO3 → KCl+3H2O+3Cl2↑制取Cl2,当产生标准状况下的气体3.36 L时,转移电子_____mol。
(4)不同环境中,物质的性质可能会有所不同。根据上述两题的反应中KClO3和Cl2的氧化性强弱比较,你能得出的结论是________________________。
(5)铝铵矾[NH4Al(SO4)212H2O]也是常用的工业净水剂,其净水的化学原理是________________(用离子方程式表示)。
(6)在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确的是_________。(选填编号)
a.n(SO42-)>n(NH4+)>n(A13+)>n(OH-)
b.n(A13+)>n(NH4+)>n(SO42-)>n(H+)
c.n(BaSO4)>n[A1(OH)3]>n(NH3·H2O)>n(A1O2-)
d.n(NH3·H2O)>n(BaSO4)>n[A1(OH)3]>n(A1O2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
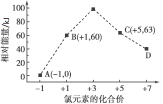
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com