
����Ŀ��
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����____________������ţ�������������Һ�����õ��IJ���������______________�����������ƣ���
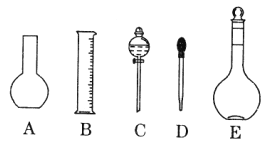
��2������ƿ�����������6���е�_________________������ţ�
�� �¶� ��Ũ�� ������ ��ѹǿ ���̶��� ����ʽ���ʽ
��3������ƿ��_________������ţ���
A������һ�����ȷŨ�ȵı���Һ |
B��������Һ |
C����������ƿ������µ����������Һ�� |
D��ȷϡ��ijһŨ�ȵ���Һ |
E�����������ܽ��������
��4�����ݼ�����������ƽ��ȡNaOH������Ϊ__________g��������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84 g/cm3��Ũ��������Ϊ��__________mL������������һλС�����������ƹ����У����в��������������ƫ�ߵ���____________������ţ���
�� δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж���
�� ����ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι�����
�� ����ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶���
�� ����ʱ�����ӿ̶���
���𰸡���1��AC �ձ��������� ��2���٢ۢ�
��3��BCE ��4��2.0 13.6 �٢�
�������������������1������ͼ����ʾ�����Ĺ����֪��A��B��C��D��E�ֱ�Ϊƽ����ƿ����Ͳ����Һ©������ͷ�ιܡ�����ƿ������һ�����ʵ���Ũ����Һ��Ҫ��������Ҫ��������ƽ����Ͳ���ձ�����������500 mL����ƿ����ͷ�ιܣ���˲���ҪAC������֮�⣬����Ҫ�IJ�������Ϊ�ձ�������������2������ƿ�Ĺ�����ͼ��ʾ
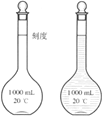 ��ƿ����ƿ���Ϸֱ�����̶��ߡ��������¶ȣ�20������û��Ũ�ȡ�ѹǿ����ʽ���ʽ����ѡ�٢ۢ�����3��A������ƿ��������һ�����ȷŨ�ȵı���Һ��B������ƿ������Һ������������Һ��������ҺӦ���Լ�ƿ��C��һ�ֹ�������ƿֻ������һ���������Һ����������С����������������Һ�壬ֻ�ܰ��մ����ԭ��ѡ������ƿ����100 < 250 < 450 < 500 < 1000�����0.1 mol/L NaOH��Һ450 mL����ѡ��500 mL����ƿ��D������ƿ��Һ����ԭ�Ͽ����ǹ��壬Ҳ������Ũ��Һ����˿�ȷijһŨ�ȵ���Һ��E������ƿ��ֻ��ע�볣�£�20��������Һ������ֱ���������ܽ��ϡ�ͣ���Ϊ�����ܽ��ϡ�Ϳ��ܷ��Ȼ����ȣ�������������������Һ��Ũ�����ϴ�ѡBCE����4�����ݴ����ԭ����ѡ��500mL����ƿ����0.1 mol/L NaOH��Һ�������m=nM=cVM����ʱ�����ܰ������·�������0.1 mol/L��450��10-3L��40g/mol = 1.8g��Ӧ��0.1 mol/L��500��10-3L��40g/mol = 2.0g��������ƽ�ľ�ȷ��Ϊ0.1g����������Ũ��������Ϊx mL������Vw��֪���ʵ�����Ϊ1.84 g/cm3��x mL��98%����m=nM=cVM��֪�����ʵ�����Ϊ0.51 mol/L��500��10-3L��98g/mol������ϡ��ǰ�����ʵ�������ȿɵã�1.84 g/cm3��x mL��98% =" 0.51" mol/L��500��10-3L��98g/mol����ã�x=13.9mL����Ͳ�ľ�ȷ��Ϊ0.1 mL������������������
��ƿ����ƿ���Ϸֱ�����̶��ߡ��������¶ȣ�20������û��Ũ�ȡ�ѹǿ����ʽ���ʽ����ѡ�٢ۢ�����3��A������ƿ��������һ�����ȷŨ�ȵı���Һ��B������ƿ������Һ������������Һ��������ҺӦ���Լ�ƿ��C��һ�ֹ�������ƿֻ������һ���������Һ����������С����������������Һ�壬ֻ�ܰ��մ����ԭ��ѡ������ƿ����100 < 250 < 450 < 500 < 1000�����0.1 mol/L NaOH��Һ450 mL����ѡ��500 mL����ƿ��D������ƿ��Һ����ԭ�Ͽ����ǹ��壬Ҳ������Ũ��Һ����˿�ȷijһŨ�ȵ���Һ��E������ƿ��ֻ��ע�볣�£�20��������Һ������ֱ���������ܽ��ϡ�ͣ���Ϊ�����ܽ��ϡ�Ϳ��ܷ��Ȼ����ȣ�������������������Һ��Ũ�����ϴ�ѡBCE����4�����ݴ����ԭ����ѡ��500mL����ƿ����0.1 mol/L NaOH��Һ�������m=nM=cVM����ʱ�����ܰ������·�������0.1 mol/L��450��10-3L��40g/mol = 1.8g��Ӧ��0.1 mol/L��500��10-3L��40g/mol = 2.0g��������ƽ�ľ�ȷ��Ϊ0.1g����������Ũ��������Ϊx mL������Vw��֪���ʵ�����Ϊ1.84 g/cm3��x mL��98%����m=nM=cVM��֪�����ʵ�����Ϊ0.51 mol/L��500��10-3L��98g/mol������ϡ��ǰ�����ʵ�������ȿɵã�1.84 g/cm3��x mL��98% =" 0.51" mol/L��500��10-3L��98g/mol����ã�x=13.9mL����Ͳ�ľ�ȷ��Ϊ0.1 mL������������������![]() =c�����Ʊ���������n�Ĵ�С�У���û�У�Ӱ��ʱ����V�Ĵ�С��û�У����У�Ӱ�죻����δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж��ݣ��������n��Ӱ�죬����ʹVƫС�����
=c�����Ʊ���������n�Ĵ�С�У���û�У�Ӱ��ʱ����V�Ĵ�С��û�У����У�Ӱ�죻����δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж��ݣ��������n��Ӱ�죬����ʹVƫС�����![]() ����c��ƫ�ߣ���������ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι��������������n��Ӱ�죬����ʹVƫ�����
����c��ƫ�ߣ���������ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι��������������n��Ӱ�죬����ʹVƫ�����![]() ����c��ƫ�ͣ���������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶��ߣ��������n��Ӱ�죬����ʹVƫ�����
����c��ƫ�ͣ���������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶��ߣ��������n��Ӱ�죬����ʹVƫ�����![]() ����c��ƫ�ͣ���������ʱ�����ӿ̶��ߣ����������VƫС������n��Ӱ�죬������
����c��ƫ�ͣ���������ʱ�����ӿ̶��ߣ����������VƫС������n��Ӱ�죬������![]() ����c��ƫ�ߣ���ѡ�٢���
����c��ƫ�ߣ���ѡ�٢���


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع�ҵ�ϳɰ���˵��������ƽ���ƶ�ԭ�����͵���
A�����ϲ��䵪��������
B��ѡ��20MPa-50MPa�ĸ�ѹ
C����ʱҺ�����백��
D��ѡ��500������ͬʱʹ������ý������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к�NaCl��Na2SO4��NaNO3�Ļ���ѡ���ʵ����Լ�����ת��Ϊ��Ӧ�ij�������壬�Ӷ�ʵ��Cl��SO42-����NO3������롣��Ӧ��ʵ����̿�����ͼ��ʾ��
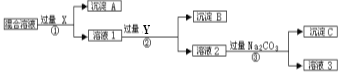
��ش��������⣺
��1��д��ʵ���������������ʵĻ�ѧʽ��
�Լ�X�����Լ�Y����
��2������ʵ�������м��������Na2CO3��Ŀ���ǡ�
��3������ʵ�鷽���õ�����Һ3�п϶��������ѧʽ�����ʣ�Ϊ�˽��������⣬��������Һ3�м��������ģ�֮����Ҫ��ù���NaNO3����е�ʵ����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�a��������м�����̬���Ļ����������������ϵ�ȼ��ը���ָ���ԭ��״̬ʱ���������С��2a�������û��������Ͽ�����
��CH4 ��C2H4 ��C2H6 ��C3H4 ��C3H6 ��C3H8
A���٢ڢ� B���٢ۢ� C���٢ڢ� D���٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ14CuSO4��5FeS2��12H2O===7Cu2S��5FeSO4��12H2SO4������˵����ȷ����
A. ֻ������ͭ��������
B. SO42���Ȳ������������ֲ��ǻ�ԭ����
C. �����������뱻��ԭ�����������Ϊ3��7
D. 1 mol����ͭ��������![]() mol����
mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�
2CO2��g�� + 6H2��g��![]() CH3OCH3��g�� + 3H2O��g�� ��H��0��
CH3OCH3��g�� + 3H2O��g�� ��H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ ��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬�������� ��
A���������ܶȲ���
B����λʱ��������2molCO2��ͬʱ����1mol������
C��v(CO2)�Uv(H2)=1�U3
D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO(g) + 2CO (g)![]() 2CO2 (g) + N2 (g)�����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
2CO2 (g) + N2 (g)�����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
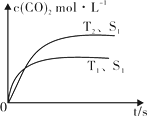
�� �÷�Ӧ����H 0��ѡ��������������������
�����������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1��S2����ͼ�л���c(CO2)��T2��S2�����´ﵽƽ������еı仯���ߡ�
��3����֪��CO��g�� + 2H2��g��![]() CH3OH��g����H = ��a kJmol-1��
CH3OH��g����H = ��a kJmol-1��
�����ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ����� | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250����ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc(CO)=0.4 mol��L��1��c(H2)=0.4 mol��L��1��c(CH3OH)=0.8 mol��L��1, ���ʱv�� v������������������������=������
��ij�¶��£�������̶���2L���ܱ������н�1 mol CO��2 mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ��(P��/Pǰ) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
��ǰ15���ӣ���������ʾ��ƽ����ѧ��Ӧ����Ϊ ���ﵽƽ��ʱCO��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1����Ҫ����NaOH���� �ˣ�
��2������ȡ�ܶ�Ϊ1.19g/cm3����������Ϊ36.5%��Ũ����________mL��
��3������ʱ�IJ����ǣ�����������ƿ�м�����ˮ�� �����ý�ͷ�ιܵμ�����ˮ�� ��
��4�����ƹ����У�����ʵ��������������Ƶ�ϡ��������ʵ���Ũ��ƫ����� ��
A����ȡŨ����ʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ |
B������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ�� |
C��ϡ��Ũ����ʱ��û����ȴ������ת�Ƶ�����ƿ�� |
D������ʱ���ӿ̶��� |
E��������ˮʱ���������˿̶��ߣ��ý���ι�����
F�����ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����7�����ʣ��ټ���ڱ��۾���ϩ����ϩ��������ױ�����ϩ����Ϊ������ѧ��Ӧ������ʹ���Ը��������Һ��ɫ����ʹ��ˮ��ɫ���ǣ� ��
A.�ۢܢ�
B.�ܢݢ�
C.�ܢ�
D.�ܢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2NO��g��+O2��g��2NO2��g����H��0�������������Ҫ��Ӧ֮һ����800��ʱ�����ݻ�Ϊ1L���ܱ������г���0.010mol NO��0.005molO2����Ӧ������NO��Ũ����ʱ��仯��ͼ��ʾ��
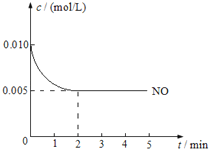
��ش�
��1��2min�ڣ�v��O2��= mol/��Lmin����
��2�������¶ȣ�ƽ���� ����������桱����Ӧ�����ƶ���
��3��ƽ��ʱ��NO��ת������ ��
��4��800��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com