
【题目】对于反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A. 只有硫酸铜作氧化剂
B. SO42-既不是氧化产物又不是还原产物
C. 被氧化的硫与被还原的硫的质量比为3∶7
D. 1 mol硫酸铜可以氧化![]() mol的硫
mol的硫
科目:高中化学 来源: 题型:
【题目】生活中的某些问题常常涉及化学知识,下列叙述错误的是
A. 纯碱可用于制造玻璃,也可用于除去物品表面的油污
B. 用聚氯乙烯代替木材生产包装盒、快餐盒等,以减少木材的使用
C. 黄河人海口沙洲的形成和卤水点豆腐,都体现了胶体聚沉的性质
D. “煤改气”、“煤改电”等燃料改造工程有利于减少环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组设计实验探究氮的化合物的性质,装置如图所示,其中A(装置未画出)为气体发生装置。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。
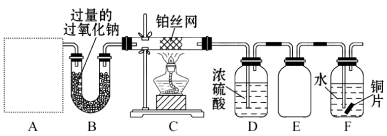
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填备选试剂的字母);
A.NH4HCO3 B.NH4Cl C.Ca(OH)2 D.NaOH
此时A中主要的玻璃仪器有 (填名称);
(2)对于C中发生的可逆反应,其方程式为: ;
有关该反应的下列说法中正确的是 。
A.增大一种反应物的浓度可以提高另一种反应物的转化率
B.工业上进行该反应时,可采取高压的条件提高反应物转化率
C.在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(3)E装置可防止F中溶液倒吸进入D中,请在上图中画出装置E中的导气管。
(4)写出F中发生反应的离子方程式: ;若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的 使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点按由高到低的顺序排列正确的是( )①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③
B.④②①③
C.④③②①
D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海洋植物海带中提取碘的流程如下:

(1)灼烧海带时,盛放海带的仪器是 。
(2)用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞
C.检查分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗上的小孔
H.静置、分层
正确的操作顺序是 。
静置分层后,下层溶液的颜色为 。
(3)从碘的CCl4溶液中获得碘晶体还需要经过蒸馏,该实验需要的玻璃仪器除酒精灯、蒸馏烧瓶、温度计、锥形瓶、牛角管外,还需要 ,实验中温度计水银球所处位置为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称)。
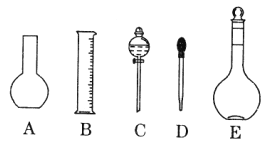
(2)容量瓶上需标有以下6项中的_________________(填序号)
① 温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
(3)容量瓶不_________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(4)根据计算用托盘天平称取NaOH的质量为__________g。需用量筒量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:__________mL(计算结果保留一位小数)。在配制过程中,下列操作中能引起误差偏高的有____________(填代号)。
① 未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中定容
② 定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③ 定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④ 定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成 18 电子的分子,该分子的结构式为 。
(2)R元素的单质与水反应的离子方程式是 。
(3)Z与Q相比,金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(4)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为 ,其中用于测定一些文物年代的核素的符号为 。
(5)写出Z2M2与X2M反应的化学方程式并标出电子转移关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3 的混合物若干克,在足量氢气中加热充分反应,冷却后称得剩余固体比原混合物减轻1.6 g;欲将等质量的原混合物与盐酸反应,欲使之完全溶解,需1 molL-1的盐酸的体积至少为( )
A.0.5 L B.0.1 L C.0.2 L D.1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
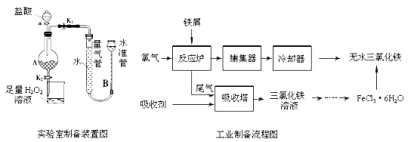
已知:(1)无水FeCl3的熔点为555K、沸点为588K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定过程中可能造成实验结果偏低的是
A.锥形瓶未润洗
B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
D.滴定终点时仰视读数
②样品中氯化铁的质量分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com