
����Ŀ������ֲ���纣�������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڣ�ʵ������Ӻ���ֲ�ﺣ������ȡ����������£�

��1�����պ���ʱ��ʢ�ź����������� ��
��2����CCl4�ӵ�ˮ����ȡ�Ⲣ�÷�Һ©������������Һ����ʵ��ɷֽ�Ϊ���¸�����
A����ʢ����Һ�ķ�Һ©����������̨����Ȧ��
B����50 mL��ˮ��15 mL���Ȼ�̼�����Һ©���У����Ǻò�����
C������Һ©���������ϿڵIJ������Ƿ�©Һ
D����ת©��������ʱ�����������������رջ������ѷ�Һ©������
E���������������ձ������²���Һ
F���ӷ�Һ©���Ͽڵ����ϲ���Һ
G������Һ©���ϿڵIJ�������ʹ���ϵİ��۶���Һ©���ϵ�С��
H�����á��ֲ�
��ȷ�IJ���˳���� ��
���÷ֲ���²���Һ����ɫΪ ��
��3���ӵ��CCl4��Һ�л�õ⾧�廹��Ҫ��������ʵ����Ҫ�IJ����������ƾ��ơ�������ƿ���¶ȼơ���ƿ��ţ�ǹ��⣬����Ҫ ��ʵ�����¶ȼ�ˮ��������λ��Ϊ ��
���𰸡���1������(�����ֲ�����)��
��2��CBDAHGEF��CBDAGHEF (ȫ�Ը���)����(��)ɫ��
��3��������/��(�����ֲ�����) �¶ȼ�ˮ������֧�ܿڸ������¶ȼ�ˮ����������֧�ܿ�����ˮƽ��
��������
�����������1�����պ���ʱ��ʢ�ź�������������������2����CCl4�ӵ�ˮ����ȡ�Ⲣ�÷�Һ©������������Һ���������Ⱥ�˳��Ϊ��©��ϴ�ӡ�װҺ����ת���������ŵ�����̨����Ȧ�ϡ����á����ǡ��ȷ��²�Һ�塢���ϲ�Һ������ΪCBDAHGEF��CBDAGHEF���²�����Ȼ�̼��Ϊ�ܽ���I2����Ϊ�Ϻ�ɫ����3��������Ҫ�ƾ��ơ�������ƿ���¶ȼơ������ܡ���ƿ��ţ�ǹ��Ȳ���������ʵ�����¶ȼ�ˮ������֧�ܿڸ����������¶ȼ�ˮ����������֧�ܿ�����ˮƽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��������ȼ����Ϊ��H=-285.5kJmol��1������ˮ���Ȼ�ѧ����ʽΪ2H2O ��l��![]() 2H2��g��+O2��g�� ��H=+285.5kJmol��1
2H2��g��+O2��g�� ��H=+285.5kJmol��1
B����ӦSO2��g��+2H2S��g��=3S��s��+2H2O��l���ڳ��������Է����У���÷�Ӧ����H��0
C��500����30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��![]() 2NH3��g����H=-38.6kJmol��1
2NH3��g����H=-38.6kJmol��1
D����C��ʯī��s��=C�����ʯ��s����H=+1.90kJmol��1��֪�����ʯ��ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����Ҫ���л�����ԭ�ϣ�������ϩ����ֱ��ˮ�Ϸ�����ˮ�Ϸ��������ش��������⣺
��1�����ˮ�Ϸ���ָ�Ƚ���ϩ��Ũ���ᷴӦ����������������C2H5OSO3H������ˮ�������Ҵ���д����Ӧ��Ӧ�Ļ�ѧ����ʽ ��
��2����֪��
�״���ˮ��Ӧ 2CH3OH��g���TCH3OCH3��g�� + H2O��g����H1=��23.9kJmol��1
�״���ϩ����Ӧ 2CH3OH��g���TC2H4��g�� + 2H2O��g����H2=��29.1kJmol��1
�Ҵ��칹����Ӧ C2H5OH��g���TCH3OCH3��g����H3=" +" 50.7kJmol��1
����ϩ����ֱ��ˮ�Ϸ�ӦC2H4��g�� + H2O��g���TC2H5OH��g������H= kJmol��1������ˮ�Ϸ���ȣ�����ֱ��ˮ�Ϸ����ŵ��� ��
��3������ֱ��ˮ�Ϸ�����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ������![]() ��
��![]() =1��1��
=1��1��
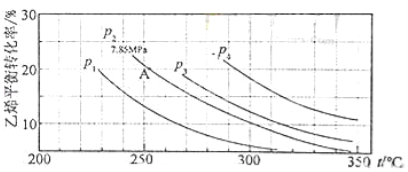
����ʽ������ϩˮ�����Ҵ���Ӧ��ͼ��A���ƽ�ⳣ��Kp= ��
��A����ѹΪ7.85MPa,��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��ͼ��ѹǿ��P1��P2��P3��P4����С˳��Ϊ �������� ��
������ֱ��ˮ�Ϸ������õĹ�������Ϊ������/������Ϊ��������Ӧ�¶�290����ѹǿ6.9MPa��![]() ��
��![]() =0.6��1����ϩ��ת����Ϊ5%����Ҫ��һ�������ϩת���ʣ����˿����ʵ��ı䷴Ӧ�¶Ⱥ�ѹǿ�⣬�����Բ�ȡ�Ĵ�ʩ�� �� ��
=0.6��1����ϩ��ת����Ϊ5%����Ҫ��һ�������ϩת���ʣ����˿����ʵ��ı䷴Ӧ�¶Ⱥ�ѹǿ�⣬�����Բ�ȡ�Ĵ�ʩ�� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�X������Y��Ӧ������Z��Ӧ���Ҷ����ڸ��ֽⷴӦ����
ѡ�� | X | Y | Z |
A | Cu | HNO3 | Fe(NO3)3 |
B | FeCl3 | Zn | NaHCO3 |
C | O2 | NH3 | SO2 |
D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��й����ĺ����ߣ����跢չ���ã���ˮ���ۺ����ô��п�Ϊ����ˮ���庬��ԼΪ65mg��L��1���Ӻ�ˮ����ȡ��Ĺ�ҵ�������£�
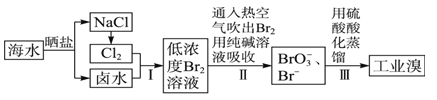
��1�����ϲ���I���ѻ������̬���壬����II�ֽ�֮ת���ɻ���̬���壬��Ŀ���� ��
��2��������ͨ���������Br2����������� ��
A�������� B����ԭ�� C���ӷ��� D����ʴ��
��3����������II���漰�����ӷ�Ӧ���£��������淽���������ʵ��Ļ�ѧ��������
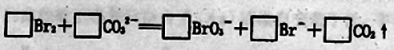
��4�����������д�������������Ҳ�����ö�������ˮ��Һ���գ�������������������д�������������ˮ��Һ��Ӧ�Ļ�ѧ����ʽ ��
��5��ʵ���ҷ����廹�������ܼ���ȡ�������п������������ȡ������ ��
A���Ҵ� B�����Ȼ�̼ C���ռ���Һ D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ14CuSO4��5FeS2��12H2O===7Cu2S��5FeSO4��12H2SO4������˵����ȷ����
A. ֻ������ͭ��������
B. SO42���Ȳ������������ֲ��ǻ�ԭ����
C. �����������뱻��ԭ�����������Ϊ3��7
D. 1 mol����ͭ��������![]() mol����
mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ[Mg��ClO3��2]����������������ݼ��ȣ�ʵ�����Ʊ�����Mg��ClO3��2��6H2O���������£�
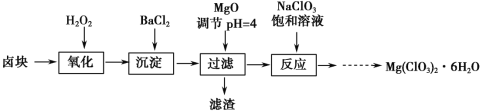
��֪����±����Ҫ�ɷ�ΪMgCl2��6H2O������MgSO4��FeCl2�����ʡ�
�����ֻ�������ܽ����S�����¶���T���仯������ͼ��ʾ��
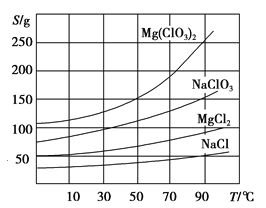
��1����������Ҫ����Ҫ����������__ __ _��
��2����MgO�����������������Ҫ�ɷ�Ϊ ��
��3������NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ_________________________��
��4����Ʒ��Mg��ClO3��2��6H2O�����IJⶨ��
����1��ȷ����3.50 g��Ʒ���100 mL��Һ��
����2��ȡ10.00 mL����ƿ�У�����10.00 mLϡ�����20.00 mL 1.000 mol��L��1��FeSO4��Һ���ȡ�
����3����ȴ�����£���0.100 mol��L��1 K2Cr2O7��Һ�ζ�ʣ���Fe2�����յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��Cr2O![]() ��6Fe2����14H��=2Cr3����6Fe3����7H2O��
��6Fe2����14H��=2Cr3����6Fe3����7H2O��
����4��������2��3�ظ����Σ�ƽ������K2Cr2O7��Һ15.00 mL��
��д������2�з�����Ӧ�����ӷ���ʽ��____________________________��
����Ʒ��Mg��ClO3��2��6H2O����������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����������������ڷ�Ӧ�����������ǣ� ��
A��̼������ȷֽ� B���Ҵ�ȼ�� C������������������Ӧ D������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Һ��ֻ���ܺ��У���Al3+����Mg2+����Fe3+����Fe2+����H+����C032-��NO3-�еļ��֣������Һ����μ���NaOH��Һ�����������ɳ�����������NaOH�����ʵ����Ĺ�ϵ��ͼ��ʾ�������Һ��һ�����е�������
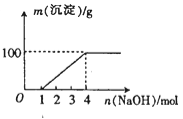
A���ڢݢ�
B���ڢۢݢ�
C���ۢݢ�
D���٢ڢۢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com