
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl、SO42-、和NO3的相互分离。相应的实验过程可用下图表示:
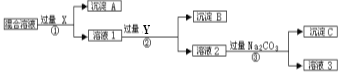
请回答下列问题:
(1)写出实验流程中下列物质的化学式。
试剂X:,试剂Y:,
(2)上述实验流程中加入过量的Na2CO3的目的是。
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
【答案】(1)BaCl2或Ba(NO3)2;AgNO3(2)使溶液中的Ag+、Ba2+完全沉淀(3)Na2CO3;稀HNO3);蒸发
【解析】
试题分析:(1)如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀;
(3)在所得滤液中加入过量的Na2CO3,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3。


科目:高中化学 来源: 题型:
【题目】浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合时,其溶质的质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是( )
A.a>b>c B.b>a>c C.c>b>a D.c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLHCl(气)溶于1L水中(水的密度为1gcm﹣3),得到的盐酸的密度为bgmL﹣1,质量分数为w,物质的量浓度为cmolL﹣1则下列关系式中不正确的是
A.w=![]()
B.w=![]()
C.C=![]()
D.b=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习和研究化学,经常要进行实验,下列关于实验安全的说法正确的是

A. 用燃着的酒精灯去点燃另一只酒精灯,若酒精灯不慎着火,应立即吹熄
B. 不慎把浓硫酸洒在皮肤上要立即用NaOH溶液冲洗
C. 做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
D. 盛放盐酸的试剂瓶上要贴上如下图的标志
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组设计实验探究氮的化合物的性质,装置如图所示,其中A(装置未画出)为气体发生装置。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。
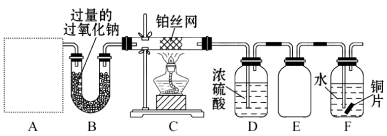
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填备选试剂的字母);
A.NH4HCO3 B.NH4Cl C.Ca(OH)2 D.NaOH
此时A中主要的玻璃仪器有 (填名称);
(2)对于C中发生的可逆反应,其方程式为: ;
有关该反应的下列说法中正确的是 。
A.增大一种反应物的浓度可以提高另一种反应物的转化率
B.工业上进行该反应时,可采取高压的条件提高反应物转化率
C.在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(3)E装置可防止F中溶液倒吸进入D中,请在上图中画出装置E中的导气管。
(4)写出F中发生反应的离子方程式: ;若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的 使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.降低温度 B.加入适量的水
C.加入少量CuSO4溶液 D.加入浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点按由高到低的顺序排列正确的是( )①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③
B.④②①③
C.④③②①
D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
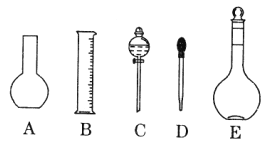
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称)。
(2)容量瓶上需标有以下6项中的_________________(填序号)
① 温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
(3)容量瓶不_________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(4)根据计算用托盘天平称取NaOH的质量为__________g。需用量筒量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:__________mL(计算结果保留一位小数)。在配制过程中,下列操作中能引起误差偏高的有____________(填代号)。
① 未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中定容
② 定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③ 定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④ 定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题.
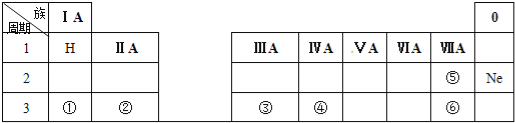
(1)元素④的符号是 ;
(2)⑤和⑥两种元素原子半径的大小关系:⑤ ⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:① ②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com