
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题

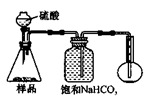
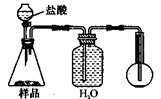
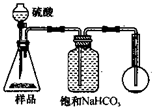
查看答案和解析>>
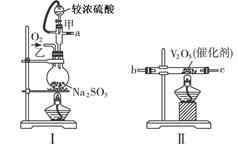
科目:高中化学 来源:不详 题型:实验题
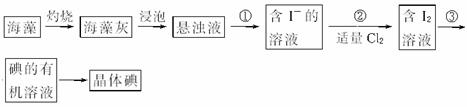
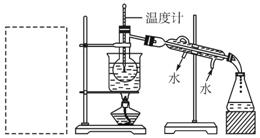
 适量___________ (填序号)溶液,反应的离子方程式为______________________。
适量___________ (填序号)溶液,反应的离子方程式为______________________。
查看答案和解析>>
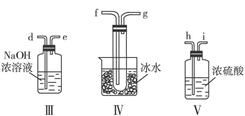
科目:高中化学 来源:不详 题型:实验题
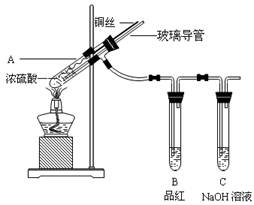
 NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)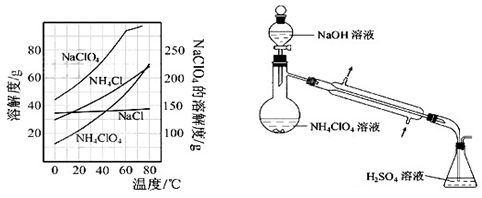

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.称量KOH固体时,直接用纸称量; |
| B.KOH固体溶解后,未完全冷却就转移至容量瓶中; |
| C.定容时,俯视容量瓶标线; |
| D.配制溶液前,容量瓶未完全干燥; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶中原有少量蒸馏水 | B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中 |
| C.定容时观察液面俯视 | D.定容时观察液面仰视 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液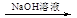 红褐色沉淀 红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | Br2 FeBr3 FeBr3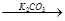 KBr KBr | 制备少量KBr溶液 |
| C | 无色试液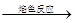 焰色呈黄色 焰色呈黄色 | 说明原溶液中一定不含钾元素 |
| D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
查看答案和解析>>
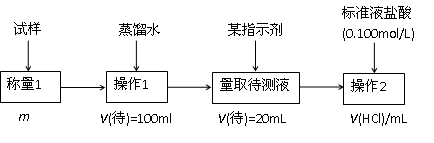
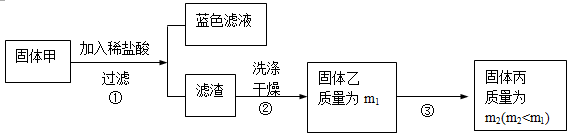
科目:高中化学 来源:不详 题型:实验题
 记下刻度。
记下刻度。 些实验
些实验 操作引起的 。
操作引起的 。| A.转移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时,反应容器摇动太激烈,有少量待测液溅出 |
| D.滴定到终点时,滴定管尖嘴悬有液滴 |
查看答案和解析>>
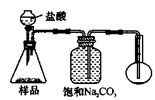
科目:高中化学 来源:不详 题型:实验题
| A.配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶 |
| B.用渗析法分离淀粉中混有的NaCl杂质 |
| C.用酸式滴定管量取20.00mL高锰酸钾溶液 |
| D.在C2H5Cl与NaOH溶液共热的混合物中,加入AgNO3溶液即可检验氯元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com