
在下列事实中,什么因素影响了化学反应速率:
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:____________。[.C
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:___________。
(3)同浓度.同体积的盐酸中分别放入同样大小的锌粒和镁条,产生气体有快有慢_______。
(4)夏天的食品易霉变,而冬天不易发生该现象:__________________。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
CO2与SO2都是酸性氧化物,具有一定的相似性。Na2O2和CO2能反应,某化学兴趣小组的同学据此认为Na2O2和SO2也能反应,为此设计了如下实验装置来验证Na2O2和SO2反应的产物。
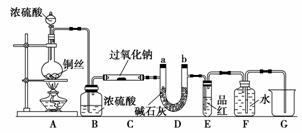
如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸。回答下列问题:
(1)点燃A处酒精灯,不久可观察到烧瓶中产生大量气体,写出反应的化学方程式:____________________________;C处玻璃管管壁发热,管内药品的颜色变化是___________________________________________________________________。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?____________________________________。
(3)E处用排水法收集气体,由什么现象可证明收集的气体中已不含SO3?________________________________________________________________________。
(4)待反应结束后,取C处玻璃管内的少量固体装入试管中,加水溶解时未产生气体,则如何证明产物中有Na2SO3?______________________________。
(5)待反应结束后,取C处玻璃管内的少量固体装入试管中,加入足量的盐酸,再加入氯化钡溶液,发现有白色沉淀生成,试分析产生沉淀的原因:________________________________________________________________________
________________________________________________________________________。
(6)有的同学认为:若将装置末端的烧杯换成量筒(或量气管),则可通过测定排水的体积来测定Na2O2药品的纯度。试判断该方案是否可行:________(填“是”或“否”),原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ
C.将反应的温度由T1升高至T2,则反应的平衡常数K1>K2
D.当反应吸热为0.25QkJ时,生成的HCl恰好与1 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸(HF)是一种弱酸。25℃时,向20mLO.1mol•L-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液充分反应。已知: HF(aq)+OH-(aq)═F-(aq)+H2O(1) △H= - 67.7kJ•mol-1,
H+(aq)+OH-(aq)═H2O (1) △H═ - 57.3kJ•mol- 根据题意,下列判断或结论正确的是
A.氢氟酸的电离过程是吸热的
B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol•L-1
C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-)
D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在带有活塞的密闭容器中发生反应:Fe2O3+3H2===2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A.增加Fe2O3的量 B.保持容器体积不变,增加H2输入量
C.减少Fe的量 D.保持容器体积不变,增加H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4
2H2SO4
B.热的纯碱溶液可以清洗油污的原因:CO32— +2H2O
 H2CO3+2OH¯
H2CO3+2OH¯
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=SiO32—+H2O
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
银氨溶液可用于检测CO气体,实验室研究的装置如图:
|
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润
红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl
中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应2SO2 + O2  2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3) =
2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3) =
2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,
此时SO2的物质的量应是( )
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明醋酸是弱电解质的事实是( )
|
| A. | 醋酸水溶液能使湿润的蓝色石蕊试纸变红 |
|
| B. | 醋酸和碳酸钠溶液反应放出二氧化碳 |
|
| C. | c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大 |
|
| D. | 物质的量浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com