
【题目】为了检验淀粉的水解情况,某同学设计了以下个实验方案,并根据实验现象,得出了相应的结论。
方案价甲:淀粉溶液![]() 水解液
水解液![]() 溶液变为蓝色
溶液变为蓝色
结论:淀粉未水解
方案乙:淀粉溶液![]() 水解液
水解液![]() 无砖红色沉淀生成
无砖红色沉淀生成
结论:淀粉未水解
方案丙:淀粉溶液![]() 水解液
水解液![]() 中和液
中和液![]() 有银镜现象
有银镜现象
结论:淀粉已经水解完全
根据上述操作及现象首先回答结论是否正确,然后简要说明理由。如果三个方案均不合理,请另设计一个方案来证明淀粉已经水解完全。
(1)方案甲:________________________________________________。
(2)方案乙:________________________________________________。
(3)方案丙:________________________________________________。
(4)你的方案:________________________________________________。
【答案】结论不正确。如果淀粉只是部分发生水解,未水解的淀粉遇碘也会变为蓝色 结论不正确。如果淀粉已发生水解生成葡萄糖,但由于水解液没有用![]() 溶液中和,加入的新制
溶液中和,加入的新制![]() 悬浊液会与稀硫酸反应,从而无法氧化葡萄糖,也就无砖红色沉淀生成 结论不正确。该实验只能证实淀粉已经发生水解,但无法证明是否水解完全
悬浊液会与稀硫酸反应,从而无法氧化葡萄糖,也就无砖红色沉淀生成 结论不正确。该实验只能证实淀粉已经发生水解,但无法证明是否水解完全 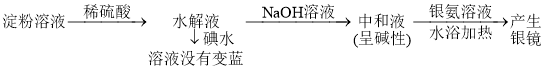 [中和液也可用新制
[中和液也可用新制![]() 悬浊液检测]
悬浊液检测]
【解析】
淀粉水解程度的检测,主要通过实验检测水解后溶液中是否有淀粉、葡萄糖,证明淀粉未水解的关键是用实验证明没有水解产物——葡萄糖生成;证明淀粉部分水解的关键是既要用实验证明有水解产物葡萄糖生成,还要用实验证明仍有未水解的淀粉存在;证明淀粉水解完全的关键是要用实验证明淀粉已不存在。淀粉是否存在的检验要在原水解液加入碘水,而检验葡萄糖的存在需要中和硫酸后的溶液进行银镜反应或与新制的氢氧化铜悬浊液反应,据此进行分析解答。
(1)溶液变蓝是因为仍存在未水解的淀粉,只能说明淀粉没有水解完全,所以方案A结论不正确;
答案为:结论不正确。如果淀粉只是部分发生水解,未水解的淀粉遇碘也会变为蓝色;
(2)B方案中没有加入碱将溶液的酸性中和掉,加入的新制Cu(OH)2悬浊液会与稀硫酸反应,从而无法氧化葡萄糖,也就无砖红色沉淀生成,所以方案B结论不正确;
答案为:结论不正确。如果淀粉已发生水解生成葡萄糖,但由于水解液没有用NaOH溶液中和,加入的新制Cu(OH)2悬浊液会与稀硫酸反应,从而无法氧化葡萄糖,也就无砖红色沉淀生成;
(3)该实验只能证实淀粉已经发生水解,但无法证明是否水解完全,方案C结论不正确,故答案为:结论不正确。该实验只能证实淀粉已经发生水解,但无法证明是否水解完全;
(4)证明淀粉已经水解完全需检验没有淀粉,并检验生成了葡萄糖,设计方案为: 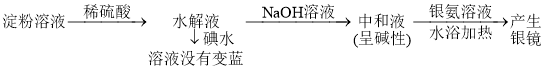 [中和液也可用新制
[中和液也可用新制![]() 悬浊液检测];
悬浊液检测];
答案为: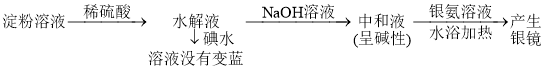 [中和液也可用新制
[中和液也可用新制![]() 悬浊液检测]。
悬浊液检测]。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
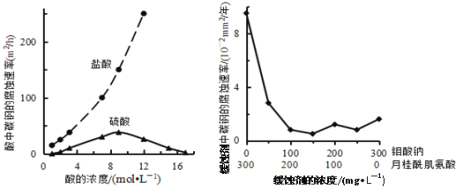
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2℃时,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示。下列说法正确的是( )
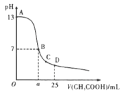
A.在A、B间任一点的溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离平衡常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol/L
D.D点对应的溶液中,存在关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) =N2(g)+3H2(g) ΔH,若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol1),则上述反应的ΔH=________kJ·mol1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
不同催化剂存在下,氨气分解反应活化能最大的是________(填写催化剂的化学式)。
(3) 电化学法也可合成氨。如图是用低温固体质子导体作为电解质,用PtC3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
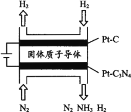
PtC3N4电极反应产生NH3的电极反应式________。
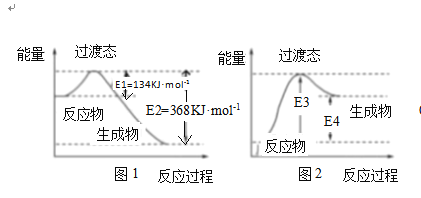
(4)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图
①试写出NO2和CO反应的热化学方程式:______
②在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=______kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
A.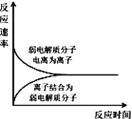 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.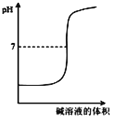 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.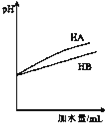 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.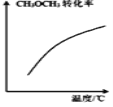 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
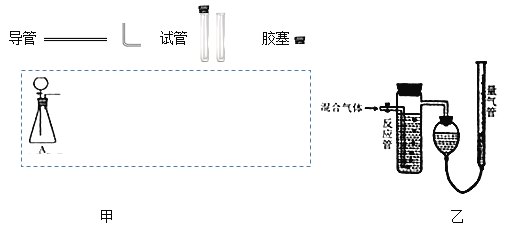
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________。
①取少量Na2SO3溶液电极附近的混合液,加入______________,产生白色沉淀,证明产生了![]() 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________。
(3)实验I中负极的电极反应式为______________。
(乙同学的实验)
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3![]()
![]() Fe(OH)3 +3SO2;②______________。
Fe(OH)3 +3SO2;②______________。
(5)查阅资料:溶液中Fe3+、![]() 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________。
(实验反思)
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com