
【题目】纯净的过氧化钙(CaO2)是白色的粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:
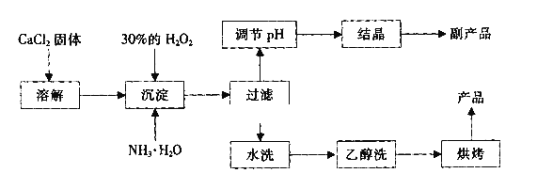
(1)用化学方程式表示出过氧化钙用做水产养殖增氧剂的原理:_______________。
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是__________________。
(3)该制法的副产品为___________(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入下列试剂中的____________(填写A或B)。
A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加__________进行检查。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2 mol·L—1的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。 (已知:I2+2S2O32-=2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是___________________________________;
②CaO2的质量分数为______________________________________(用字母表示)
【答案】2CaO2+2H2O=2Ca(OH) 2+O2↑ 冰水浴冷却(或将反应容器浸泡在冰水中) NH4Cl A 稀硝酸酸化的硝酸银溶液 溶液由蓝色变为无色 ![]()
【解析】
(1)实验的目的为制备CaO28H2O,则流程中的沉淀应为CaO28H2O,根据质量守恒判断还应有NH4Cl生成,根据质量守恒定律可写出反应的化学方程式;
(2)CaO28H2O在0℃时稳定,为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却可以达到实验目的;
(3)根据反应生成物判断反应的副产物;反应物中氨水过量,为充分回收副产品,应加入盐酸吸收;
(4)据检验Cl-离子的方法,可用稀硝酸酸化的硝酸银溶液检验;
(5)根据反应的离子方程式,CaO2+4H++2I-=Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式CaO2~2S2O32-,并以此进行计算。
(1)本实验的目的为制备CaO28H2O,则流程中的沉淀应为CaO28H2O,根据质量守恒判断还应有NH4Cl生成,故可写出反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO28H2O↓+2NH4Cl或CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl;
(2)CaO28H2O在0℃时稳定,为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却(或将反应容器浸泡在冰水中);可以达到实验目的;
(3)根据反应反应方程式可判断该反应生成CaO28H2O和NH4Cl,副产物是NH4Cl,反应物中氨水过量,为充分回收副产品,应加入盐酸吸收,选项是A;
(4)滤液中含有大量的Cl-离子,为将沉淀洗涤干净,应充分洗涤,根据检验Cl-离子的方法,可用稀硝酸酸化的硝酸银溶液检验,若加入硝酸银溶液后无沉淀生成,证明洗涤干净,否则未洗涤干净。反应的离子方程式为:Cl-+Ag+═AgCl↓;
(5)①CaO2具有强氧化性,溶液中加入KI晶体和淀粉溶液,生成的碘单质遇淀粉变蓝色,反应的离子方程式为:CaO2+4H++2I-═Ca2++2H2O+I2,若反应完全,则滴加最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且30s不恢复蓝色;
②根据反应的离子方程式CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,得关系式CaO2~~2S2O32-
72g 2mol
m cV×10-3mol
m=![]() =
=![]() g;则CaO2的质量分数为:
g;则CaO2的质量分数为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol N2O4气体充入容积为10L的密闭容器中,回答下列问题:

(1)100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为________________;反应N2O4(g)![]() 2NO2(g)的平衡常数K为___________。
2NO2(g)的平衡常数K为___________。
(2)当反应达到平衡时,对于反应N2O4(g)![]() 2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是____________。
2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是____________。
①气体颜色加深
②N2O4的体积分数增加
③恒温恒压充入He
④单位时间内消耗N2O4和NO2的物质的量之比等于1:2
(3)若起始时充入1molNO2气体,建立如下平衡2NO2(g)![]() N2O4(g),测得NO2的转化率为a%,在温度、体积不变时,再充入1molNO2气体,重新达到平衡时,测得NO2的转化率为b%,则a______b(填“>”、“<”或“=”);若恒温恒压时,充入1molNO2气体,反应2NO2(g)
N2O4(g),测得NO2的转化率为a%,在温度、体积不变时,再充入1molNO2气体,重新达到平衡时,测得NO2的转化率为b%,则a______b(填“>”、“<”或“=”);若恒温恒压时,充入1molNO2气体,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量的NO2气体,重新达到平衡时,NO2的体积分数_________(填“不变”、“增大”或“减小”)。
N2O4(g)达到平衡后,再向容器内通入一定量的NO2气体,重新达到平衡时,NO2的体积分数_________(填“不变”、“增大”或“减小”)。
(4)如下图a所示,连通的玻璃瓶中充入NO2气体,建立如下平衡2NO2(g)![]() N2O4(g),已知Fe3+对H2O2的分解具有催化作用,根据图b、c中的信息,推测A瓶中气体颜色比B瓶中的____________(填“深”或“浅”)。
N2O4(g),已知Fe3+对H2O2的分解具有催化作用,根据图b、c中的信息,推测A瓶中气体颜色比B瓶中的____________(填“深”或“浅”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com