
【题目】(1)同一物质在气态时的能量大于在液态时的能量。一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______(填“大于”“小于”或“等于”)Q2。
(2)已知:4HCl+O2=2Cl2+2H2O,该反应中,4molHCl被氧化,放出115.6kJ的热量,则断开1molH—O键与断开1molH—Cl键所需能量相差约为______kJ。

(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图:
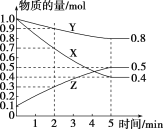
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率之比为3:1
C.容器内气体的压强保持不变
D.容器内气体的总质量保持不变
③0~2min内Y的转化率为________。
【答案】小于 31.9 3X(g)+Y(g)2Z(g) AC 10%
【解析】
(1)氢气燃烧分别生成液态水和气态水,由气态水转化为液态水还要放出热量,故Q1<Q2;
答案为:小于;
(2)用E(H—O)、E(H—Cl)分别表示H—O键、H—Cl键的键能,该反应中,4molHCl被氧化,放出115.6kJ的热量,则反应物总键能-生成物总键能=-115.6kJ·mol-1,故4×E(H—Cl)+498kJ·mol-1-2×243kJ·mol-1-4×E(H—O)=-115.6kJ·mol-1,整理得4E(H—Cl)-4E(H—O)=-127.6kJ·mol-1,即E(H—O)-E(H—Cl)=31.9kJ·mol-1,故断开1molH—O键与断开1molH—Cl键所需能量相差约为31.9kJ·mol-1×1mol=31.9kJ;
答案为:31.9;
(3)①由题图可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到5min时,Δn(Y)=0.2mol,Δn(Z)=0.4mol,Δn(X)=0.6mol,则Δn(Y)∶Δn(Z)∶Δn(X)=1:2:3,则化学方程式中各物质前化学计量数之比为1:2:3,则反应的化学方程式为3X(g)+Y(g)2Z(g);
答案为:3X(g)+Y(g)2Z(g);
②A. Y的体积分数在混合气体中保持不变,则已达平衡,A正确;
B. 平衡时正反应速率和逆反应速率相等,而同一方向的X、Y的反应速率之比始终为3:1,故X、Y的反应速率之比为3:1,不能作为平衡状态的标志,B错误;
C. 反应3X(g)+Y(g)2Z(g)从开始到平衡的过程中,4L容器内的气体物质的量和气体压强始终在变化,当容器内气体的压强保持不变,也即各气体的物质的量保存不变,则已平衡,C正确;
D. 容器内气体的总质量始终保持不变,故容器内气体的总质量保持不变不能作为平衡状态的标志, D错误;
答案为:AC;
③0~2min内Y的转化率=![]() ×100%=
×100%=![]() ×100%=10%;
×100%=10%;
答案为:10%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
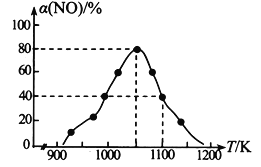
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
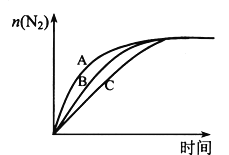
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成巴比妥类镇静药物的中间体,一种以丙烯为原料合成H的路线如下:
![]()
已知:①A、B、C均可发生银镜反应。
②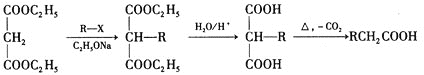
请回答下列问题:
(1)A的化学名称是___,B中官能团的名称是___。
(2)由C生成D中反应i的化学方程式为___。
(3)E的结构简式为___,由E生成F的反应类型是___。
(4)与H互为同分异构体且与C互为同系物的有机物有___种,其中核磁共振氢谱有3组峰的结构简式为___(任写一种)。
(5)设计由乙烯、乙醇钠和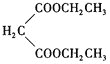 为原料制备2-乙基丁酸的合成路线
为原料制备2-乙基丁酸的合成路线![]() 无机试剂任选
无机试剂任选![]() ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
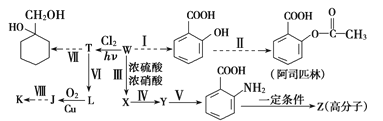
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照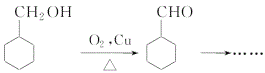 )_______
)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+===Fe2+ + 2Fe3+ + 4H2O
B. Na2O2 加入H218O 中:2Na2O2 + 2H2l8O ===4Na+ + 4OH-+ 18O2↑
C. 水玻璃中通入过量二氧化碳:Na2SiO3 +CO2 + H2O===2Na+ +CO32- + H2SiO3↓
D. 成分为盐酸的洁厕灵与“84”消毒液混合使用易中毒:C1—+ C1O—+ 2H+=== Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:___。
(2)配平该方程式:__FeC2O4·2H2O+__H2O2+__K2C2O4+__H2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式___;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:K=![]() 。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每一步转化都能通过一步反应实现的是( )
①Fe → FeCl2 → Fe(OH)2 → Fe(OH)3
②Si → SiO2 → H2SiO3 → Na2SiO3
③Al → Al2O3 → Al(OH) 3 → AlCl3
④NH3 →NO2 → HNO3 → NH4NO3
⑤Na → Na2O → Na2CO3 → NaHCO3 → NaOH
A.②③⑤B.①⑤C.①④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com