
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl(忽略溶液体积变化)下列关于该电池装置工作时的说法正确的是( )
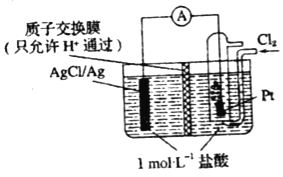
A.H+向左侧迁移
B.若有11.2L氯气(标准状况)参与反应,左侧电极质量增加71 g
C.左侧电极区反应为Ag﹣e﹣═Ag+
D.若把质子交换膜换成阴离子交换膜,一段时间右侧c(HCl)几乎不变
【答案】D
【解析】
电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,负极反应式为Cl-+Ag-e-=AgCl↓,正极反应式为Cl2+2e-═2Cl-,以此解答该题。
A.原电池中阳离子移向正极,H+向右侧迁移,故A错误;
B.若有11.2L氯气(标准状况)参与反应,物质的量为![]() 0.5mol,Cl2+2e-=2Cl-,电子转移1mol,负极反应式为Cl-+Ag-e-=AgCl↓,左侧电极质量增加35.5g,故B错误;
0.5mol,Cl2+2e-=2Cl-,电子转移1mol,负极反应式为Cl-+Ag-e-=AgCl↓,左侧电极质量增加35.5g,故B错误;
C.负极反应式为Cl-+Ag-e-=AgCl↓,故C错误;
D.放电时,当电路中转移amol e-时,交换膜左则会有amol氢离子通过阳离子交换膜向正极移动,同时会有amol Ag失去amol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少amol,则交换膜左侧溶液中约减少2amol离子,如果换成阴离子交换膜,由于氯离子可以向左迁移,且右室氯离子的生成量与向左室的迁移量、左室的消耗量均相等,故c(HCl)几乎不变,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】AgI可用于人工降雨。AgI溶于水,溶液中离子浓度与温度的关系如图所示,已知:pAg=-lgc(Ag+),pI=-lgc(I-)。下列说法正确的是( )
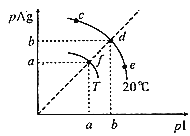
A.图象中,T<20℃
B.AgI的溶度积Ksp(AgI):c=d=e<f
C.20℃时,AgI粉末溶于饱和KI溶液中c(Ag+)=1×10-bmolL-1
D.在d点饱和AgI溶液中加AgNO3粉末,d点移动到f点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。
②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+ 中Cu+ 与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
①配离子[Cu(En)2]2+的中心原子基态第L层电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是: 。
③配合物[Cu(En)2]Cl2中不存在的作用力类型有 (填字母);
A 配位键 B 极性键 C 离子键 D 非极性键 E.氢键 F.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是( )
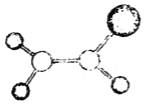
A.该有机物的分子式可能为C2HCl3
B.该有机物分子中的所有原子在同一平面上
C.该有机物无相同官能团同分异构体
D.该有机物可以和氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe3+的电子排布式是_____________________________________________
(2)下列物质中既有离子键又有共价键的是________。
A.MgO B.NaOH C.CaCl2 D.CO2
(3) 关于下列分子的说法不正确的是________。
A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(4)下列说法正确的是________。
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH3和CH4的空间构型相似
C.BF3与![]() 都是平面型分子
都是平面型分子
D.CO2和H2O都是直线型分子
(5)下列有关性质的比较,正确的是________。
A.第一电离能:O>N
B.水溶性:CH3CH2OH>CH3OCH3
C.沸点:H2S>H2O
D.晶格能:NaCl>MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硫是高中化学学习的两种重要非金属元素
(1)下列C原子的电子排布式表达的状态中能量最高的是_____。
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1
(2)硫有一种结构为![]() 的分子(灰球代表硫原子)。其中硫原子杂化方式为_____。
的分子(灰球代表硫原子)。其中硫原子杂化方式为_____。
(3)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为_____。
(4)已知CS2晶体结构类似于干冰。CS2晶体中与每个CS2分子距离最近且等距的CS2分予有_____个。推测CS2晶体密度与冰的晶体密度较大的为_____。可能的原因是_____。又知CS2晶体中晶胞参数是apm,NA表示阿佛加德罗常数的值,晶体密度为_____g/cm3(用含a、NA等符号的表达式表示)。
(5)Na2S是高子晶体,其晶格能可通过图的Born﹣Haber循环计算得到。
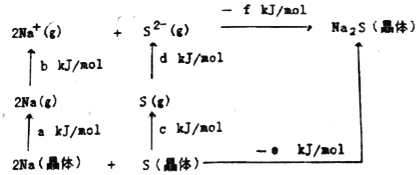
由此可知,Na原子的第一电离能为_____kJ/mol,Na2S的晶格能为_____kJ/mol。(用图中给出的符号作答)
查看答案和解析>>
科目:高中化学 来源: 题型:
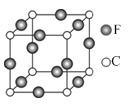
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)F原子的电子排布式是______________。
(2)B、C、D元素的第一电离能由大到小的顺序是(用元素符号表示)__________________。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是____________;B、C的这些氢化物的沸点相差较大的主要原因是_______________。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是______________;1 mol该分子中含有π键的数目是____________。
(5)写出两种与D3分子互为等电子体的微粒_________。
(6)由A、D、E三种元素组成的两种常见化合物酸性由强到弱为__________,其原因是_________。
(7)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是__________________,C原子的配位数是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。完成下列填空:
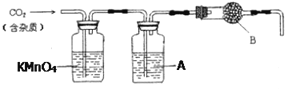
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有___________
(2)上述装置中,A是___________溶液,其作用是___________ 。
(3)上述装置中,B物质是___________。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的____________类,为了将石蜡从饭盒中溶出,应选用下列试剂中的__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2OH++Cl-+HClO
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2=2C6H5OH+CO32-
D.实验室制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com