
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)F原子的电子排布式是______________。
(2)B、C、D元素的第一电离能由大到小的顺序是(用元素符号表示)__________________。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是____________;B、C的这些氢化物的沸点相差较大的主要原因是_______________。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是______________;1 mol该分子中含有π键的数目是____________。
(5)写出两种与D3分子互为等电子体的微粒_________。
(6)由A、D、E三种元素组成的两种常见化合物酸性由强到弱为__________,其原因是_________。
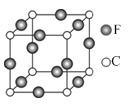
(7)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是__________________,C原子的配位数是__________________。
【答案】 1s22s22p63s23p63d104s1{或Ar]3d104s1} N>O>C C2H6 氮的氢化物(N2H4)分子间存在氢键 sp2 NA SO2、NO2- H2SO4>H2SO3 二者中H2SO4分子中非羟基氧的个数多,所以H2SO4分子中S的正电性更高,导致S-O-H键中O的电子更向S偏移,更容易电离出H+,故H2SO4的酸性更强些。 Cu3N 6
【解析】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大;元素A是原子半径最小的元素,则A是H元素;B元素基态原子的核外电子分占四个原子轨道(能级),则B为C元素;D元素原子的已成对电子总数是未成对电子总数的3倍,则D是O元素,C元素原子序数大于B而小于D,则C是N元素;E与D处于同一主族,则E是S元素;F位于ds区,且原子的最外层只有1个电子,则F为Cu元素。
(1)Cu原子核外有29个电子,根据构造原理,铜原子核外电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)B、C、D分别是C、N、O元素,且位于同一周期,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)C、N元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物为C2H6;含有氢键的氢化物熔沸点较高,氮的氢化物中含有氢键而碳的氢化物中不含氢键,所以氮的氢化物熔沸点较高,故答案为:C2H6;氮的氢化物(N2H4)分子间存在氢键;
(4)H、C、O可形成分子式为H2CO的某化合物,为HCHO,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2;一个甲醛分子中含有1个π键,则1mol甲醛中含有1molπ键,故答案为:sp2;NA;
(5)与O3分子互为等电子体的微粒有SO2、NO2-,故答案为:SO2、NO2-;
(6)由H、O、S三种元素组成的两种常见化合物为硫酸和亚硫酸,酸性由强到弱的顺序为H2SO4>H2SO3,原因是二者中H2SO4分子中非羟基氧的个数多,所以H2SO4分子中S的正电性更高,导致S-O-H键中O的电子更向S偏移,更容易电离出H+,故H2SO4的酸性更强些,故答案为:H2SO4>H2SO3;二者中H2SO4分子中非羟基氧的个数多,所以H2SO4分子中S的正电性更高,导致S-O-H键中O的电子更向S偏移,更容易电离出H+,故H2SO4的酸性更强些;
(7)N、Cu两元素形成的某化合物的晶胞结构如图所示,该晶胞中Cu原子个数=12×![]() =3、N原子个数=8×
=3、N原子个数=8×![]() =1,所以其化学式为Cu3N;该晶胞中N原子配位数为6,故答案为:Cu3N;6。
=1,所以其化学式为Cu3N;该晶胞中N原子配位数为6,故答案为:Cu3N;6。


科目:高中化学 来源: 题型:
【题目】某小组探究纯净物M(由2种短周期元素组成)的化学式,进行如图实验(气体体积均在标准状况下测定):

实验测定,①2.40g金属E与稀硫酸按n(E):n(H2SO4)=1:1反应能放出2.24LH2(标准状况);②金属E能在NH3中剧烈燃烧,当E和NH3按n(E):n(NH3)=1:2反应时产物的物质的量之比为1:1。
回答下列问题:
(1)A分子的结构式为___。
(2)M的化学式为___。
(3)M与水反应的化学方程式为___。
(4)E在氨气中燃烧的化学方程式为___。
(5)蒸干C溶液中HCl的作用是___。
(6)电解熔融D时阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NixO晶体晶胞结构为NaCl型(如图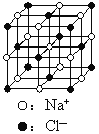 ),由于晶体缺陷,x值于小于1。测知NixO晶体密度ρ为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283=78.4 ,
),由于晶体缺陷,x值于小于1。测知NixO晶体密度ρ为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283=78.4 ,![]() =1.414)
=1.414)
(1)晶胞中两个Ni离子之间的最短距离___________(精确至0.01)。
(2)与O2-距离最近且等距离的Ni离子围成的几何体形状_______。
(3)求NixO中x值为_________(精确至0.01)。
(4)晶体中的Ni分别为Ni2﹢、Ni3﹢,求此晶体的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl(忽略溶液体积变化)下列关于该电池装置工作时的说法正确的是( )
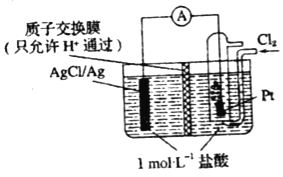
A.H+向左侧迁移
B.若有11.2L氯气(标准状况)参与反应,左侧电极质量增加71 g
C.左侧电极区反应为Ag﹣e﹣═Ag+
D.若把质子交换膜换成阴离子交换膜,一段时间右侧c(HCl)几乎不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
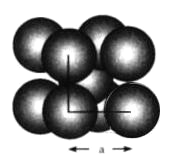
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(1)W在元素周期表中的位置___________________,实验室制取W单质的离子方程式是____________________________________________________________;
(2)A、B均由上述四种元素中的三种组成的强电解质,A是一种强碱,B是某种家用消毒液的有效成分,则A、B的化学式分别为___________、____________;
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1∶1,则C的电子式是____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳烃如萘![]() 、菲
、菲 、芘
、芘 等均为重要的有机化工原料。下列说法正确的是
等均为重要的有机化工原料。下列说法正确的是
A. 萘、菲、芘互为同系物B. 萘、菲、芘的一氯代物分别为2、5、3种
C. 萘、菲、芘中只有萘能溶于水D. 萘、菲、芘的所有原子不可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。请回答:

(1)A中所含官能团的名称为___;
(2)Ⅰ的反应类型为___(填字母序号),Ⅲ的反应类型为___;
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(3)D的分子式为___;
(4)写出下列反应的化学方程式:
Ⅰ:___;
Ⅱ:___;
III:C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为___;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,写出其顺式结构的结构简式___;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com