
【题目】某小组探究纯净物M(由2种短周期元素组成)的化学式,进行如图实验(气体体积均在标准状况下测定):

实验测定,①2.40g金属E与稀硫酸按n(E):n(H2SO4)=1:1反应能放出2.24LH2(标准状况);②金属E能在NH3中剧烈燃烧,当E和NH3按n(E):n(NH3)=1:2反应时产物的物质的量之比为1:1。
回答下列问题:
(1)A分子的结构式为___。
(2)M的化学式为___。
(3)M与水反应的化学方程式为___。
(4)E在氨气中燃烧的化学方程式为___。
(5)蒸干C溶液中HCl的作用是___。
(6)电解熔融D时阳极的电极反应式为__。
【答案】HC≡CH MgC2 MgC2+2H2O=Mg(OH)2+C2H2↑ Mg+2NH3![]() Mg(NH2)2+H2↑ 抑制MgCl2水解 2Cl--2e=Cl2↑
Mg(NH2)2+H2↑ 抑制MgCl2水解 2Cl--2e=Cl2↑
【解析】
由实验①知,n(H2)=0.1mol,n(E)=n(H2SO4)=0.1mol,E的质量为2.4g,E的相对原子质量为24,E为镁。由实验②知,镁与氨气反应生成Mg(NH2)2和H2,NH3类似H2O。由气体A燃烧生成CO2和H2O可知,气体A含有C,H元素,说明M是由镁和碳两种元素组成,设M的化学式为MgCn,与水反应生成5. 8gMg(OH)2,4.8gM中含有C的物质的量为4.8g-![]() =0.2mol,n(A)=0.1mol,说明M的化学式为MgC2,气体A为C2H2。
=0.2mol,n(A)=0.1mol,说明M的化学式为MgC2,气体A为C2H2。
(1)C2H2中的C和C之间存在三键,分子的结构式为:HC≡CH;
(2)M为碳化镁,类似碳化钙,化学式为:MgC2;
(3)碳化镁与水反应生成氢氧化镁和乙炔(C2H2),化学方程式为MgC2+2H2O=Mg(OH)2+C2H2↑;
(4)镁在氨气中燃烧的条件是“点燃”,燃烧的化学方程式为:Mg+2NH3![]() Mg(NH2)2+H2↑。
Mg(NH2)2+H2↑。
(5)MgCl2在水中水解,氯化氢作用是抑制氯化镁水解,制备无水氯化镁;
(6)电解熔融氯化镁时阴极发生还原反应生成镁,阳极上发生氧化反应生成氯气,电极反应式为2Cl--2e=Cl2↑;


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。
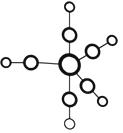
(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。
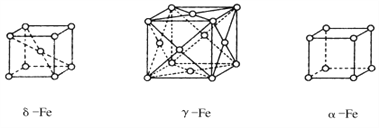
①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等。回答下列问題:
⑴二价铜离子的电子排布式为 ,已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。

⑵如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
⑶往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
⑷铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点。其原因是 。
⑸硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3NH3,在BF3NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
⑹六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞结构如下图所示,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AgI可用于人工降雨。AgI溶于水,溶液中离子浓度与温度的关系如图所示,已知:pAg=-lgc(Ag+),pI=-lgc(I-)。下列说法正确的是( )
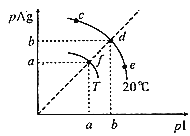
A.图象中,T<20℃
B.AgI的溶度积Ksp(AgI):c=d=e<f
C.20℃时,AgI粉末溶于饱和KI溶液中c(Ag+)=1×10-bmolL-1
D.在d点饱和AgI溶液中加AgNO3粉末,d点移动到f点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1molL-1Na2X溶液中缓慢滴加0.1molL-1盐酸溶液(不逸出H2X),溶液pH与溶液中lg![]() 之间关系如图所示。下列说法错误的是( )
之间关系如图所示。下列说法错误的是( )
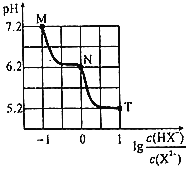
A.M点:c(X2-)>c(HX-)>c(OH-)>c(H+)
B.常温下,0.1molNa2X和1molNaHX同时溶于水得到溶液pH=5.2
C.N点:c(Na+)<3c(X2-)+c(Cl-)
D.常温下,X2-第一步水解常数Kh1的数量级为10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
![]()
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol 咖啡酸最多能与5 mol H2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A 的分子式为C8H10O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名
(1)![]() ____________________________________________
____________________________________________
(2)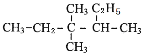 ___________________________________________
___________________________________________
(3)![]() ___________________________
___________________________
(4)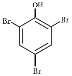 ________________________________________
________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。
②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+ 中Cu+ 与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
①配离子[Cu(En)2]2+的中心原子基态第L层电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是: 。
③配合物[Cu(En)2]Cl2中不存在的作用力类型有 (填字母);
A 配位键 B 极性键 C 离子键 D 非极性键 E.氢键 F.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)F原子的电子排布式是______________。
(2)B、C、D元素的第一电离能由大到小的顺序是(用元素符号表示)__________________。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是____________;B、C的这些氢化物的沸点相差较大的主要原因是_______________。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是______________;1 mol该分子中含有π键的数目是____________。
(5)写出两种与D3分子互为等电子体的微粒_________。
(6)由A、D、E三种元素组成的两种常见化合物酸性由强到弱为__________,其原因是_________。
(7)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是__________________,C原子的配位数是__________________。
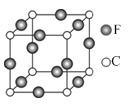
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com