
【题目】常温下,向20mL0.1molL-1Na2X溶液中缓慢滴加0.1molL-1盐酸溶液(不逸出H2X),溶液pH与溶液中lg![]() 之间关系如图所示。下列说法错误的是( )
之间关系如图所示。下列说法错误的是( )
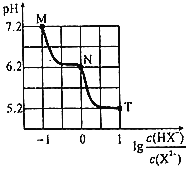
A.M点:c(X2-)>c(HX-)>c(OH-)>c(H+)
B.常温下,0.1molNa2X和1molNaHX同时溶于水得到溶液pH=5.2
C.N点:c(Na+)<3c(X2-)+c(Cl-)
D.常温下,X2-第一步水解常数Kh1的数量级为10-8
【答案】B
【解析】
A.M点对应的溶液中,c(X2-)=10c(HX-),pH>7,呈碱性,c(OH- )>c(H+ ),溶液中离子浓度大小排序为c(X2-)>c(HX-)>c(OH- )>c(H+ ),A项正确;
B.1 mol NaHX和0.1 mol Na2X投人水中,NaHX电离大于Na2X水解,故溶液中lg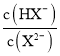 <1,pH>5.2,B项错误;
<1,pH>5.2,B项错误;
C.N点对应的溶液中电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-)+c(C1-),c(H+)>c(OH-),c(HX-)=c(X2-),整理得:c(Na+)<3c(X2-)+c(C1-),C项正确;
D.常温下,X2-+H2OHX-+OH-,选择N点对应的数据计算,Kb1= 1×10-7.8=10-8×100.2,1<100.2<10,数量级为10-8,故D正确;
1×10-7.8=10-8×100.2,1<100.2<10,数量级为10-8,故D正确;
答案选B。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
![]()
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5KJ的热量,请写出该反应的热化学方程式____;
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____。
②在该温度下,计算该反应的平衡常数K=____。
③下列选项中能表示该反应已达到平衡状态的是____
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | span>φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
(4)合成气制甲醚的反应方程式为2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。
CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。

① 290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是____;
② b____0,(填“>”或“<”或“=”)理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习选修5的学生必做题
(1)由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是( )
A.C2H4、C3H8 B.CH4、C5H8 C.CH4、C4H8 D.C2H6、C3H8
(2)下列变化中,由加成反应引起的是( )
A.乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色
B.苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷
C.一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成
D.由电石制乙炔
(3)下列说法正确的是( )
B.所有汽油都可以用于萃取溴水中的溴
C.通过核磁共振氢谱图可以知道有机物的空间等效氢原子种类和数目
D.分子式为C6H12的烯烃,主链上有四个碳原子的同分异构体只有4种
(4)以煤为原料制备一些化工产品的前景被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。
![]()
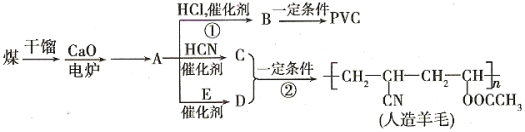
请回答下列问题:
①反应①反应类型________________E中官能团名称__________。
②写出结构简式:PVC_________________C_____________________。
③写出反应③的化学方程式:_____________________________________________。
④写出A![]() D的化学反应方程式___________________________________________。
D的化学反应方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,Y、Z原子最外层电子数之和等于X原子最外层电子数的2倍,R和Y位于同主族。R、X和Z构成一种分子的结构式如图所示,下列说法错误的是( )
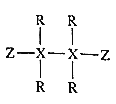
A.原子半径:Y>Z>X>R
B.YR和YZ都是离子化合物
C.Z的氧化物对应的水化物是强酸
D.常温常压下,X的氢化物可能呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究纯净物M(由2种短周期元素组成)的化学式,进行如图实验(气体体积均在标准状况下测定):

实验测定,①2.40g金属E与稀硫酸按n(E):n(H2SO4)=1:1反应能放出2.24LH2(标准状况);②金属E能在NH3中剧烈燃烧,当E和NH3按n(E):n(NH3)=1:2反应时产物的物质的量之比为1:1。
回答下列问题:
(1)A分子的结构式为___。
(2)M的化学式为___。
(3)M与水反应的化学方程式为___。
(4)E在氨气中燃烧的化学方程式为___。
(5)蒸干C溶液中HCl的作用是___。
(6)电解熔融D时阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A. 接通电路后,电池的正极质量减小
B. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C. M电极材料为铜片
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数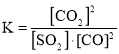 ,据以上信息,请写出该反应的热化学反应方程式:________________。
,据以上信息,请写出该反应的热化学反应方程式:________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为______,H2的化学反应速率为_____。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为______,H2的化学反应速率为_____。
(3)工业利用反应2SO2(g)+O2(g) ![]() 2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______
a 体系压强保持不变
b 混合气体密度保持不变
c SO2和O2的物质的量保持不变
d 每消耗1 mol SO3的同时,生成0.5 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
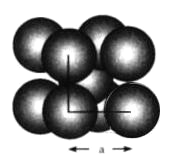
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com