
【题目】一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数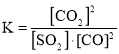 ,据以上信息,请写出该反应的热化学反应方程式:________________。
,据以上信息,请写出该反应的热化学反应方程式:________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为______,H2的化学反应速率为_____。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为______,H2的化学反应速率为_____。
(3)工业利用反应2SO2(g)+O2(g) ![]() 2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______
a 体系压强保持不变
b 混合气体密度保持不变
c SO2和O2的物质的量保持不变
d 每消耗1 mol SO3的同时,生成0.5 mol O2
【答案】SO2(g)+2CO(g) ![]() 2CO2(g)+S(s) △H=-270kJ·mol-1; 75% 0.045mol·L-1·min-1 a、c
2CO2(g)+S(s) △H=-270kJ·mol-1; 75% 0.045mol·L-1·min-1 a、c
【解析】
(1)已知某反应的平衡常数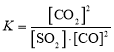 ,则该反应的方程式为SO2(g)+2CO(g)2CO2(g)+S(s),根据盖斯定律结合已知方程式计算反应热;
,则该反应的方程式为SO2(g)+2CO(g)2CO2(g)+S(s),根据盖斯定律结合已知方程式计算反应热;
(2)根据所给反应的平衡常数,利用三段式法计算浓度变化值结合公式计算;
(3)学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(1)已知某反应的平衡常数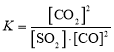 ,则该反应的方程式为SO2(g)+2CO(g)2CO2(g)+S(s),
,则该反应的方程式为SO2(g)+2CO(g)2CO2(g)+S(s),
①C(s)+O2(g)=CO2(g)△H1=-393.5kJmol -1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJmol -1
③S(s)+O2(g)=SO2(g)△H3=-296.0kJmol -1,
由盖斯定律①-②-③可得SO2(g)+2CO(g)2CO2(g)+S(s) △H=-270kJmol-1;
故答案为:SO2(g)+2CO(g)2CO2(g)+S(s) △H=-270kJmol-1;
(2)设参加反应的CO的浓度为x
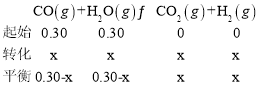
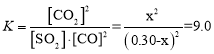 ,解得x=0.225mol/L,所以CO的转化率α(CO)=
,解得x=0.225mol/L,所以CO的转化率α(CO)=
![]() ×100%=75%,氢气反应速率v(H2)=
×100%=75%,氢气反应速率v(H2)=![]() =0.045mol/(Lmin),故答案为:75%;0.045mol/(Lmin);
=0.045mol/(Lmin),故答案为:75%;0.045mol/(Lmin);
(3)a.反应前后气体的体积不等,故容器总压强随时间改变,当压强不再随着时间变化时,即达到化学平衡状态,故a正确;
b.总质量不变,体积不变,故混合气体的密度始终不变,所以不能作为判断是否达到化学平衡状态的依据,故b错误;
c.起始SO2和O2的物质的量之比为1:2,而反应过程中按照2:1的比例进行反应,所以SO2和O2的物质的量之比不变时说明反应达到平衡,故c正确;
d.每消耗1mol SO3为逆反应速率,同时,生成0.5mol O2也为逆反应速率,任一时刻不同物质表示的同一方向速率之比等于计量数之比,故d错误;故答案为:ac;


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
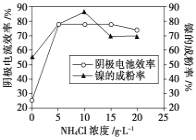
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1molL-1Na2X溶液中缓慢滴加0.1molL-1盐酸溶液(不逸出H2X),溶液pH与溶液中lg![]() 之间关系如图所示。下列说法错误的是( )
之间关系如图所示。下列说法错误的是( )
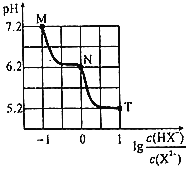
A.M点:c(X2-)>c(HX-)>c(OH-)>c(H+)
B.常温下,0.1molNa2X和1molNaHX同时溶于水得到溶液pH=5.2
C.N点:c(Na+)<3c(X2-)+c(Cl-)
D.常温下,X2-第一步水解常数Kh1的数量级为10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名
(1)![]() ____________________________________________
____________________________________________
(2)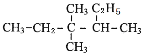 ___________________________________________
___________________________________________
(3)![]() ___________________________
___________________________
(4)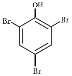 ________________________________________
________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
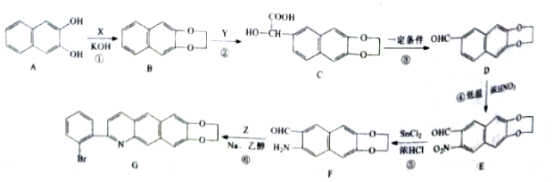
【题目】化合物G是一种具有抗痢疾的某种药物的中间体,其合成路线如图:
已知:![]() +R3NH2
+R3NH2![]() +H2O
+H2O
(1)X的分子式为C2H4Cl2,写出其化学名称____。
(2)①的反应类型为____。
(3)D中官能团的名称为____。
(4)E的分子式为____。
(5)芳香族化合物Z的分子式为C8H7OBr,写出Z的结构简式____。
(6)同时满足下列条件的D的同分异构体有多种,写出任意一种的结构简式____。
①能与氯化铁发生显色反应
②能与纯碱反应放出二氧化碳气体
③除苯环外无其他环状结构
④核磁共振氢谱为四组峰,峰面积比为1:1:2:6
(7)写出![]() 和
和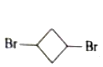 为有机原料制备
为有机原料制备![]() 的流程图。____
的流程图。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。
②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+ 中Cu+ 与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
①配离子[Cu(En)2]2+的中心原子基态第L层电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是: 。
③配合物[Cu(En)2]Cl2中不存在的作用力类型有 (填字母);
A 配位键 B 极性键 C 离子键 D 非极性键 E.氢键 F.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物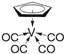 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。
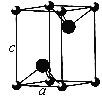
①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe3+的电子排布式是_____________________________________________
(2)下列物质中既有离子键又有共价键的是________。
A.MgO B.NaOH C.CaCl2 D.CO2
(3) 关于下列分子的说法不正确的是________。
A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(4)下列说法正确的是________。
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH3和CH4的空间构型相似
C.BF3与![]() 都是平面型分子
都是平面型分子
D.CO2和H2O都是直线型分子
(5)下列有关性质的比较,正确的是________。
A.第一电离能:O>N
B.水溶性:CH3CH2OH>CH3OCH3
C.沸点:H2S>H2O
D.晶格能:NaCl>MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫(SO2)是一种在空间地理、环境科学、地质勘探等领域受到广泛研究的一种气体。
Ⅰ.某研究小组设计了一套制备及检验SO2部分性质的装置,如图所示:
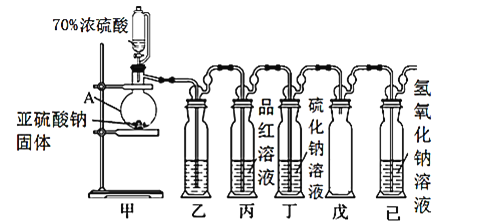
(1)仪器A的名称____________。
(2)装置乙的作用是为了观察生成SO2的速率,则装置乙中加入的试剂是____________。
(3)①实验前有同学提出质疑:该装置没有排空气,而空气中的O2氧化性强于SO2,因此装置丁中即使有浑浊现象也不能说明是SO2导致的。请你写出O2与Na2S溶液反应的化学反应方程式____________。
②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表:
序号 | 实验操作 | 实验现象 |
1 | 向10 mL 1 mol/L Na2S溶液中通O2 | 15 min后,溶液才出现浑浊 |
2 | 向10 mL 1 mol/L Na2S溶液中通SO2 | 溶液立即出现黄色浑浊 |
由实验现象可知:该实验条件下Na2S溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是____________。
Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是以氮气为载体,以稀盐酸、淀粉和碘化钾的混合溶液为吸收液,用0.0010 mol·L-1KIO3标准溶液进行滴定。检测装置如图所示:
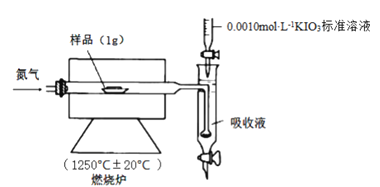
[查阅资料] ①实验进行5min样品中的S元素都可转化为SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2O=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
(4)工业设定的滴定终点现象是____________。
(5)实验一:不放样品进行实验,5 min后测得消耗标准液体积为V1
实验二:加入1 g样品再进行实验,5 min后测得消耗标准液体积为V2
①比较数据发现V1远远小于V2,可忽略不计。则设置实验一的目的是___________。
②测得V2的体积如表:
序号 | 1 | 2 | 3 |
KIO3标准溶液体积/mL | 10.02 | 9.98 | 10.00 |
该份铁矿石样品中硫元素的质量百分含量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com