
ЁОЬтФПЁПЮяжЪAгаШчЭМЫљЪОЕФзЊЛЏЙиЯЕ(ВПЗжВњЮявбТдШЅ)ЃЌвбжЊHФмЪЙфхЕФCCl4ШмвКЭЪЩЋЁЃ
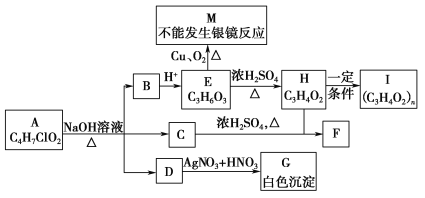
ЛиД№ЯТСаЮЪЬтЃК
(1)1 mol EгызуСПNaOHШмвКЗДгІЪБЃЌЯћКФNaOHЕФЮяжЪЕФСПЮЊ________ molЁЃ
(2)MЕФФГаЉЭЌЗжвьЙЙЬхФмЗЂЩњвјОЕЗДгІЃЌаДГіЦфжаЕФСНжжНсЙЙМђЪНЃК________________ЁЂ________________ЁЃ
(3)аДГіЛЏбЇЗНГЬЪНHЈDЁњIЃК_____________________________________ЃЌCЃЋHЈDЁњFЃК____________________________________________________ЁЃ
(4)EЭЈГЃПЩгЩБћЯЉЁЂNaOHШмвКЁЂH2ЁЂO2ЁЂBr2ЕШЮЊдСЯКЯГЩЃЌЧыАДЁАAЈDЁњBЈDЁњCЈDЁњЁЁБЕФаЮЪНаДГіЗДгІСїГЬЃЌВЂдкЁАЈDЁњЁБЩЯзЂУїЗДгІРраЭ__________ЁЃ
ЁОД№АИЁП1 OHCCH2COOHЁЂOHCCH(OH)CHO OHCCOOCH3 nCH2=CHCOOH![]()
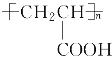 CH3OHЃЋCH2=CHCOOH
CH3OHЃЋCH2=CHCOOH![]() CH2===CHCOOCH3ЃЋH2O CH3CH=CH2
CH2===CHCOOCH3ЃЋH2O CH3CH=CH2![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ЁОНтЮіЁП
HдквЛЖЈЬѕМўЯТЗДгІЩњГЩIЃЌЗДгІЧАКѓИїдЊЫиЕФзщГЩБШВЛБфЃЌЧвHФмЪЙфхЕФCCl4ШмвКЭЪЩЋЃЌЫЕУїHЗДгІЩњГЩIгІЮЊМгОлЗДгІЫЕУїHжаКЌгаC=CЃЌдђHЮЊCH2=CHCOOHЃЌIЮЊ![]() ЃЌгЩДЫПЩжЊEгІЮЊCH3CHOHCOOHЃЌБЛбѕЛЏЩњГЩ
ЃЌгЩДЫПЩжЊEгІЮЊCH3CHOHCOOHЃЌБЛбѕЛЏЩњГЩ![]() ЃЌВЛФмЗЂЩњвјОЕЗДгІЃЌBгІЮЊCH3CHOHCOONaЃЌЫЕУїAдкМюадЬѕМўЯТЩњГЩCH3CHOHCOONaЁЂNaClКЭДМЃЌЖдБШЗжзгзщГЩПЩжЊИУДМЮЊCH3OHЃЌдђAгІЮЊCH3CHClCOOCH3ЃЌНсКЯгаЛњЮяЕФНсЙЙКЭаджЪНтД№ИУЬтЁЃ
ЃЌВЛФмЗЂЩњвјОЕЗДгІЃЌBгІЮЊCH3CHOHCOONaЃЌЫЕУїAдкМюадЬѕМўЯТЩњГЩCH3CHOHCOONaЁЂNaClКЭДМЃЌЖдБШЗжзгзщГЩПЩжЊИУДМЮЊCH3OHЃЌдђAгІЮЊCH3CHClCOOCH3ЃЌНсКЯгаЛњЮяЕФНсЙЙКЭаджЪНтД№ИУЬтЁЃ
ЃЈ1ЃЉEЮЊCH3CHOHCOOHЃЌЗжзгжажЛга-COOHОпгаЫсадЃЌФмгыNaOHЗДгІЃЌдђ1molEгызуСПЕФNaOHШмвКЗДгІЪБЃЌЯћКФNaOHЮяжЪЕФСПЮЊ1molЃЌЙЪД№АИЮЊЃК1ЁЃ
ЃЈ2ЃЉMЮЊ![]() ЃЌЦфЖдгІЕФЭЌЗжвьЙЙЬхФмЗЂЩњвјОЕЗДгІЃЌЫЕУїЗжзгжаКЌгаCHOЛђHCOO-ЕШЙйФмЭХЃЌЖдгІЕФЭЌЗжвьЙЙЬхПЩФмгаOHCCH2COOHЁЂOHCCHЃЈOHЃЉCHOЛђOHCCOOCH3ЕШЃЌЙЪД№АИЮЊЃКOHCCH2COOHЁЂOHCCHЃЈOHЃЉCHOЛђOHCCOOCH3ЁЃ
ЃЌЦфЖдгІЕФЭЌЗжвьЙЙЬхФмЗЂЩњвјОЕЗДгІЃЌЫЕУїЗжзгжаКЌгаCHOЛђHCOO-ЕШЙйФмЭХЃЌЖдгІЕФЭЌЗжвьЙЙЬхПЩФмгаOHCCH2COOHЁЂOHCCHЃЈOHЃЉCHOЛђOHCCOOCH3ЕШЃЌЙЪД№АИЮЊЃКOHCCH2COOHЁЂOHCCHЃЈOHЃЉCHOЛђOHCCOOCH3ЁЃ
ЃЈ3ЃЉHЮЊCH2=CHCOOHЃЌПЩЗЂЩњМгОлЗДгІЩњГЩ![]() ЃЌЗДгІЗНГЬЪНЮЊЃКnCH2=CHCOOH
ЃЌЗДгІЗНГЬЪНЮЊЃКnCH2=CHCOOH![]()
![]() ЃЛCH2=CHCOOHгыCH3OHЗЂЩњѕЅЛЏЗДгІЩњГЩCH2=CHCOOCH3ЃЌЗДгІЗНГЬЪНЮЊCH3OH+CH2=CHCOOH
ЃЛCH2=CHCOOHгыCH3OHЗЂЩњѕЅЛЏЗДгІЩњГЩCH2=CHCOOCH3ЃЌЗДгІЗНГЬЪНЮЊCH3OH+CH2=CHCOOH![]() CH2=CHCOOCH3+H2OЃЌЙЪД№АИЮЊЃКnCH2=CHCOOH
CH2=CHCOOCH3+H2OЃЌЙЪД№АИЮЊЃКnCH2=CHCOOH![]()
![]() ЃЛCH3OH+CH2=CHCOOH
ЃЛCH3OH+CH2=CHCOOH![]() CH2=CHCOOCH3+H2OЁЃ
CH2=CHCOOCH3+H2OЁЃ
ЃЈ4ЃЉгЩБћЯЉЁЂNaOHШмвКЁЂH2ЁЂO2ЁЂBr2ЕШЮЊдСЯКЯГЩCH3CHOHCOOHЃЌПЩЩцМАвдЯТЗДгІСїГЬЃКCH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br![]() CH3CHOHCH2OH
CH3CHOHCH2OH![]()
![]()
![]()
![]()
![]()
![]() ЃЌЙЪД№АИЮЊЃКCH3CH=CH2
ЃЌЙЪД№АИЮЊЃКCH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br![]() CH3CHOHCH2OH
CH3CHOHCH2OH![]()
![]()
![]()
![]()
![]()
![]() ЁЃ
ЁЃ


 аЁбЇНЬВФЭъШЋНтЖСЯЕСаД№АИ
аЁбЇНЬВФЭъШЋНтЖСЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаКЌNaClЁЂNa2SO4КЭNaNO3ЕФЛьКЯШмвКЃЌВЩгУЯТСаЪЕбщСїГЬМгШыЪЪЕБЕФЪдМСНЋЦфзЊЛЏЮЊЯргІЕФГСЕэЛђЙЬЬхЃЌЪЕЯжCl-ЁЂSO42-КЭNO3-ЕФЯрЛЅЗжРыЃКЦфжаЪдМС1ЁЂ2ЁЂ4ЗжБ№ЮЊ( )

A.ТШЛЏБЕШмвКЁЂЯѕЫсвјШмвКЁЂЯЁЯѕЫс
B.ТШЛЏБЕШмвКЁЂЯЁЯѕЫсЁЂЯѕЫсвјШмвК
C.ЧтбѕЛЏФЦШмвКЁЂЯѕЫсвјШмвКЁЂЯЁЯѕЫс
D.ЯѕЫсвјШмвКЁЂЯѕЫсБЕШмвКЁЂЯЁЯѕЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдЊЫиXЕФЃЋ1МлРызгXЃЋжаЫљгаЕчзге§КУГфТњKЁЂLЁЂMШ§ИіЕчзгВуЃЌЫќгыN3ЃаЮГЩЕФОЇЬхНсЙЙШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
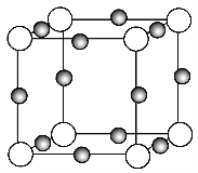
A. XдЊЫиЕФдзгађЪ§ЪЧ19 B. XЕФОЇЬхОпгаСМКУЕФЕМЕчадЁЂЕМШШадКЭбгеЙад
C. XЃЋРызгЪЧЭМжаЕФКкЧђ D. ИУОЇЬхжабєРызггывѕРызгИіЪ§БШЮЊ3ЁУ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПзуСПЭгывЛЖЈСПХЈЯѕЫсЗДгІЃЌЕУЕНЯѕЫсЭШмвККЭNO2ЁЂN2O4ЁЂNOЕФЛьКЯЦјЬхЃЌетаЉЦјЬхгы1.68LO2(БъзМзДПі)ЛьКЯКѓЭЈШыЫЎжаЃЌЫљгаЦјЬхЭъШЋБЛЫЎЮќЪеЩњГЩЯѕЫсЁЃШєЯђЫљЕУЯѕЫсЭШмвКжаМгШы3mol/LNaOHШмвКжСCu2+ЧЁКУЭъШЋГСЕэЃЌдђЯћКФNaOHШмвКЕФЬхЛ§ЪЧ
A.60 mLB.75 mLC.80 mLD.100 mL
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПI. ЯТСаЪЕбщЗНАИКЯРэЕФЪЧ________ЁЃ
AЃЎХфжЦвјАБШмвКЃКдквЛЖЈСПAgNO3ШмвКжаЃЌЕЮМгАБЫЎжСГСЕэЧЁКУШмНт
BЃЎдкМьбщШЉЛљХфжЦCu(OH)2аќзЧвКЪБЃЌдквЛЖЈСПCuSO4ШмвКжаЃЌМгШыЩйСПNaOHШмвК
CЃЎбщжЄRXЮЊЕтДњЭщЃЌАбRXгыЩеМюЫЎШмвКЛьКЯМгШШЃЌНЋШмвКРфШДКѓдйМгШыЯѕЫсвјШмвК
DЃЎЮоЫЎввДМКЭХЈСђЫсЙВШШЕН170 ЁцЃЌНЋжЦЕУЕФЦјЬхЭЈШыЫсадИпУЬЫсМиЃЌПЩМьбщжЦЕУЕФЦјЬхЪЧЗёЮЊввЯЉ
EЃЎввЭщжаЛьгаввЯЉЃЌЭЈЙ§ЧтЦјдквЛЖЈЬѕМўЯТЗДгІЃЌЪЙввЯЉзЊЛЏЮЊввЭщ
FЃЎГ§ШЅЛьдкБНжаЕФЩйСПБНЗгЃЌМгШыЙ§СПфхЫЎЃЌЙ§ТЫ
GЃЎЪЕбщЪвжЦШЁввЯЉЪББиаыНЋЮТЖШМЦЕФЫЎвјЧђВхШыЗДгІвКжаЃЌВтЖЈЗДгІвКЕФЮТЖШ
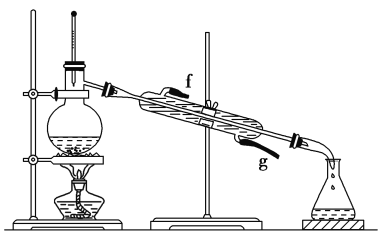
II.ФГЛЏбЇаЁзщВЩгУРрЫЦжЦввЫсввѕЅЕФзАжУ(ШчЯТЭМ)ЃЌвдЛЗМКДМжЦБИЛЗМКЯЉЁЃ
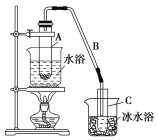
вбжЊЃК +H2O
+H2O
УмЖШ(gЁЄcmЃ3) | ШлЕу(Ёц) | ЗаЕу(Ёц) | ШмНтад | |
ЛЗМКДМ | 0.96 | 25 | 161 | ФмШмгкЫЎ |
ЛЗМКЯЉ | 0.81 | Ѓ103 | 83 | ФбШмгкЫЎ |
(1)жЦБИДжЦЗЃК
НЋ12.5 mLЛЗМКДММгШыЪдЙмAжаЃЌдйМгШы1 mLХЈСђЫсЃЌвЁдШКѓЗХШыЫщДЩЦЌЃЌЛКТ§МгШШжСЗДгІЭъШЋЃЌдкЪдЙмCФкЕУЕНЛЗМКЯЉДжЦЗЁЃ
ЂйAжаЫщДЩЦЌЕФзїгУЪЧ________________ЃЌЂкЕМЙмBГ§СЫЕМЦјЭтЛЙОпгаЕФзїгУЪЧ__________ЁЃ
(2)жЦБИОЋЦЗЃК
ЂйЛЗМКЯЉДжЦЗжаКЌгаЛЗМКДМКЭЩйСПЫсаддгжЪЕШЁЃМгШыБЅКЭЪГбЮЫЎЃЌеёЕДЁЂОВжУЁЂЗжВуЃЌЛЗМКЯЉдк________(ЬюЁАЩЯЁБЛђЁАЯТЁБ)ВуЃЌЗжвККѓгУ______(ЬюБрКХ)ЯДЕгЁЃ
aЃЎKMnO4ШмвКЁЁ bЃЎЯЁH2SO4ЁЁ cЃЎNa2CO3ШмвК
ЂкдйНЋЛЗМКЯЉАДЯТЭМзАжУеєСѓЃЌРфШДЫЎДг________(ЬюЁАfЁБЛђЁАgЁБ)ПкНјШыЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ1LКЌ0.01molNaAlO2КЭ0.02molNaOHЕФШмвКжаЛКТ§ЭЈШыЖўбѕЛЏЬМЃЌЫцn(CO2)діДѓЃЌЯШКѓЗЂЩњШ§ИіВЛЭЌЕФЗДгІЃЌЕБ0.01mol<n(CO2) ![]() 0.015ЪБЗЂЩњЕФЗДгІЪЧЃК2 NaAlO2+ CO2+2H2O=2Al(OH)3Ё§+Na2CO3ЯТСаЖдгІЙиЯЕе§ШЗЕФЪЧ( )
0.015ЪБЗЂЩњЕФЗДгІЪЧЃК2 NaAlO2+ CO2+2H2O=2Al(OH)3Ё§+Na2CO3ЯТСаЖдгІЙиЯЕе§ШЗЕФЪЧ( )
бЁЯю | n(CO2)/mol | ШмвКжаРызгЕФЮяжЪЕФСПХЈЖШ |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25 ЁцЪБЃЌгУNa2SГСЕэCu2ЃЋЁЂZn2ЃЋСНжжН№ЪєбєРызг(M2ЃЋ)ЃЌЫљашS2ЃзюЕЭХЈЖШЕФЖдЪ§жЕlgc(S2Ѓ)гыlgc(M2ЃЋ)ЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
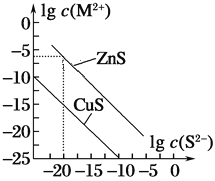
A.ЯђCu2ЃЋХЈЖШЮЊ1ЁС10Ѓ5 molЁЄLЃ1ЕФЙЄвЕЗЯЫЎжаМгШыZnSЗлФЉЃЌЛсгаCuSГСЕэЮіГі
B.25 ЁцЪБЃЌKsp(CuS)дМЮЊ1ЁС10Ѓ35
C.Яђ100 mL Zn2ЃЋЁЂCu2ЃЋХЈЖШОљЮЊ1ЁС10Ѓ5 molЁЄLЃ1ЕФЛьКЯШмвКжаж№ЕЮМгШы1ЁС10Ѓ4 molЁЄLЃ1ЕФNa2SШмвКЃЌCu2ЃЋЯШГСЕэ
D.Na2SШмвКжаЃКc(S2Ѓ)ЃЋc(HSЃ)ЃЋc(H2S)ЃН2c(NaЃЋ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊЪЕЯжЫцДІПЩЩЯЭјЃЌжаЙњЗЂЩфСЫЁАжааЧ16КХЁБЮРаЧЁЃNH4ClO4ЪЧЛ№М§ЕФЙЬЬхШМСЯЃЌЗЂЩњЗДгІЮЊ2NH4ClO4 ![]() N2Ёќ+Cl2Ёќ+2O2Ёќ+4H2OЃЌNAДњБэАЂЗќМгЕТТоГЃЪ§ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
N2Ёќ+Cl2Ёќ+2O2Ёќ+4H2OЃЌNAДњБэАЂЗќМгЕТТоГЃЪ§ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. 1mol NH4ClO4ШмгкЫЎКЌNH4+КЭClO4ЃРызгЪ§ОљЮЊNA
B. ЗДгІжаЛЙдВњЮяЗжзгЪ§гыбѕЛЏВњЮяЗжзгзмЪ§жЎБШЮЊ1:3
C. ВњЩњ6.4g O2ЗДгІзЊвЦЕФЕчзгзмЪ§ЮЊ0.8NA
D. 0.5mol NH4ClO4ЗжНтВњЩњЕФЦјЬхЬхЛ§ЮЊ44.8L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧжабЇЛЏбЇжаГЃгУгкЛьКЯЮяЕФЗжРыКЭЬсДПзАжУЃЌЧыИљОнзАжУЛиД№ЮЪЬтЃК
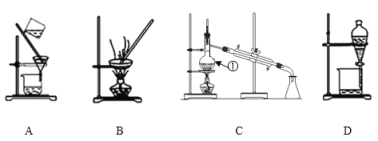
(1)дкзАжУAКЭзАжУBжаЖМгУЕНВЃСЇАєЃЌзАжУAжаВЃСЇАєЕФзїгУЪЧ___ЁЃ
(2)зАжУCжаЂйЕФУћГЦЪЧ___ЃЌДЫзАжУжаРфФ§ЫЎНјГіЗНЯђЪЧ___(ЬюЁАЩЯНјЯТГіЁБЛЙЪЧЁАЯТНјЩЯГіЁБ)ЁЃзАжУDжаЕФЗжвКТЉЖЗдкЪЙгУжЎЧАгІИУ___ЃЌдкЗжвКЪБЮЊЪЙвКЬхЫГРћЕЮЯТЃЌгІНјааЕФОпЬхВйзїЪЧ___ЁЃ
(3)ФГЯѕЫсФЦЙЬЬхжаЛьгаЩйСПСђЫсФЦдгжЪЃЌЯжЩшМЦвЛЪЕбщЗНАИЃЌМШГ§ШЅдгжЪЃЌгжХфГЩЯѕЫсФЦШмвКЁЃЪЕбщЗНАИЃКЯШНЋЙЬЬхШмгкеєСѓЫЎХфГЩШмвКЃЌбЁдёКЯЪЪЕФЪдМСКЭВйзїЭъГЩБэИёжаИїВНЪЕбщЁЃ
бЁдёЪЪЕБЪдМСАДЫГађЬэМг | Ђй | Na2CO3ШмвК | Ђм |
ЪЕбщВйзї | Ђк | Ђл | МгШШ |
ЫљМгШыЕФЪдМСЂйПЩвдЪЧ___(ЬюЛЏбЇЪН)ЃЌжЄУїШмвКжаSO42-вбОГ§ОЁЕФЗНЗЈЪЧ___ЁЃМгШыNa2CO3ШмвКЕФФПЕФЪЧ___ЃЌЫљМгШыЕФЪдМСЂмПЩвдЪЧ___(ЬюЛЏбЇЪН)ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com