
 有机化合物键线式的特点是以表示键,每个拐点和端点均有表示一个碳原子,并以氢原子补足四价,C、H不表示出来,某有机化合物的立体结构如图所示.
有机化合物键线式的特点是以表示键,每个拐点和端点均有表示一个碳原子,并以氢原子补足四价,C、H不表示出来,某有机化合物的立体结构如图所示.科目:高中化学 来源: 题型:
 用图中的装置Ⅰ通电10分钟后,去掉直流电源,连接成装置Ⅱ,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升,下列说法正确的是( )
用图中的装置Ⅰ通电10分钟后,去掉直流电源,连接成装置Ⅱ,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升,下列说法正确的是( )| A、用装置Ⅱ进行实验时铁电极的电极反应为:Fe-2e-+2OH-=Fe(OH)2 |
| B、用装置Ⅱ进行实验时石墨电极的电极反应为:2H++2e-=H2↑ |
| C、同温、同压下,装置I中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| D、装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )| A、点c处正反应速率和逆反应速率相等 |
| B、点a的正反应速率比点b的大 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不同 |
| D、在t2时刻,正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
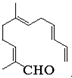 从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D元素原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F位于周期表的第七列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.CO(g)的燃烧热△H为-283.0kJ?mol-1,已知1mol甲醇(CH3OH)完全燃烧放出热量为726.5kJ.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.CO(g)的燃烧热△H为-283.0kJ?mol-1,已知1mol甲醇(CH3OH)完全燃烧放出热量为726.5kJ.请回答下列问题:| nA |
| lA |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(OH-)=c(CH3COO-)+c(H+) |
| C、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com