
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由其中两种上述元素组成的化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
A.原子半径:Y>Z>W>X
B.简单气态氢化物的热稳定性:Z>Y
C.物质M具有漂白性
D.Q既能与强酸溶液反应,又能与强碱溶液反应
【答案】A
【解析】
P能使湿润的红色石蕊试纸变蓝,则P为氨气,N常温常压下为液体,主族元素形成的化合物,常温常压下为液体的常见的是H2O,则已确定三种元素:H、N、O,M为同族元素形成的化合物,则为SO2,则Q为亚硫酸氢铵或亚硫酸铵,受热分解生成NH3、SO2、H2O。
由分析可知,P为NH3,M为SO2,N为H2O,X、Y、Z、W分别为H、N、O、S。
A.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径:S>N>O>H,故A错误;
B.非金属性:O>N,则简单气态氢化物的热稳定性:H2O>NH3,故B正确;
C.M为SO2,具有漂白性,故C正确;
D.Q可能为亚硫酸铵或亚硫酸氢铵,既能与强酸溶液反应,又能与强碱溶液反应,故D正确;
故答案为A。


科目:高中化学 来源: 题型:
【题目】碘酸钾作为食盐—碘添加剂,而碘化钾则是化工生产中一种重要原料。还原法生产碘化钾是由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原而得,其主要流程如图。
请回答下列问题:
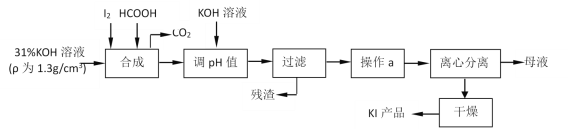
(1)判断“合成”过程中,碘是否已完全反应的方法是___。
(2)实验室中,过滤操作要求“一贴二低三靠”,其中“三靠”是指盛有被过滤液体的烧杯注液口紧靠玻璃棒、___、___。
操作a包括“蒸发浓缩、冷却结晶”是依据KI具有何种性质:___。
(3)写出“合成”过程中,HCOOH参与的离子反应方程式:___。
(4)测定产品中KI含量的方法是:
a.称取3.340g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于锥形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3与KI反应完全;
c.以淀粉为指示剂,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液体积平均值为10.00mL。
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-。
①测定过程所需仪器在使用前必须检查是否漏液的有___。
②该样品中KI的质量分数为___。(保留3位有效数字)
(5)有学生选用家庭厨房中的有关调料(如黄酒、白醋、酱油、味精等),用简便方法来检测是否是加碘食盐。通过实践,发现厂商只要在食盐包装的封口处夹一条碘化钾淀粉试纸,并在袋上注明使用方法就能鉴别真伪。现请你写出检测使用说明书___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:

已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH

请回答:
(1)Y的化学式为______________
(2)写出化合物H的结构简式_______________。
(3)下列说法不正确的是______________。
A.B的一氯代物有三种
B.反应①②③④均属于取代反应
C.化合物G→Y的转化过程中,涉及的反应类型有取代反应、加成反应
D.反应①的试剂与条件为Cl2/光照
E. 化合物E能发生银镜反应
(4)写出反应④的化学方程式________________。
(5)芳香族化合物M是B的同分异构体,M含有二个六元环(且两个二元环共用两个相邻的碳原子),则M可能的结构有_______________。(任写两种)
(6)已知一个碳原子上连有两个羟基是不稳定的,会脱水转化为羰基。:![]() .写出以
.写出以![]() 为原料制备合成
为原料制备合成 的线路图。___________
的线路图。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(![]() )是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
)是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
实验室通过图7装置模拟其制备过程。请回答下列问题:
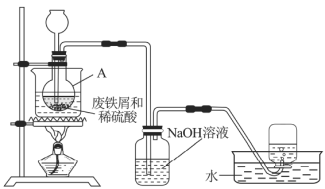
(1)进行实验之前需检查整套装置的______。装置甲中仪器A的名称是______,铁和稀硫酸反应后所得溶液呈______色。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生![]() 等副产物,因此,采用水浴加热,并使用过量的
等副产物,因此,采用水浴加热,并使用过量的![]() 将可能产生的
将可能产生的![]() 还原成
还原成![]() 。
。![]() 还原
还原![]() 的离子方程式为______________。
的离子方程式为______________。
(3)为验证反应后A中溶液是否含![]() ,取A中少量溶液快速冷却后,迅速滴入几滴
,取A中少量溶液快速冷却后,迅速滴入几滴![]() 溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)
溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)![]() 。
。
(4)废铁屑中含有硫化物杂质,故反应中会生成少量的![]() 气体。因此,装置乙中
气体。因此,装置乙中![]() 溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
(5)将![]() 废铁屑(
废铁屑(![]() 单质的质量分数为80%,杂质为
单质的质量分数为80%,杂质为![]() 和
和![]() )与
)与![]() 的
的![]() 溶液充分反应,
溶液充分反应,![]() 的理论产量为____
的理论产量为____![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的两组装置,回答下列问题:
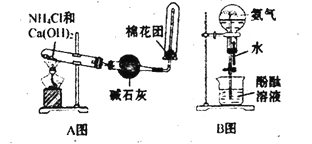
(1)用A图所示的装置可制备干燥的NH3,反应的化学方程式为:___。干燥管中干燥剂能否改用无水CaCl2?__。(填“能”或“不能”)检验NH3是否收集满的实验方法是:__。氨气溶于水呈碱性的原因是:___。
(2)若要配制100mL9.0mol/L的氨水,用到的玻璃仪器有烧杯、玻璃棒、量筒、___、__。
(3)将等浓度、等体积的氨水和盐酸混合,所得溶液中离子浓度从大到小的顺序为___。
(4)用B图所示的装置可进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是__,该实验的原理是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为___。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为___。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)铅精矿浸取后“趁热过滤”的原因是___。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是___。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于___(填“阴极室”或“阳极室”)中。
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式___。
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___(用a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
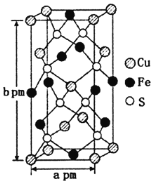
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
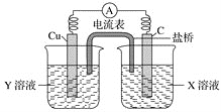
①写出电极反应式:
正极___________;负极__________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。
2Fe2++I2设计成如图所示的原电池。
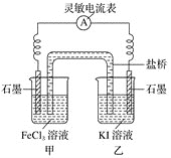
请回答下列问题:
①反应开始时,乙中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为________。甲中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为______。
②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作________(填“正”或“负”)极,该电极的电极反应式为________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染等行业。以硫化铜精矿为原料生产CuCl的工艺如图:
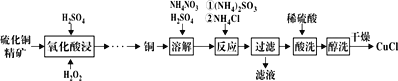
已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl-![]() CuCl2-],潮湿空气中易水解氧化。
CuCl2-],潮湿空气中易水解氧化。
(1)“氧化酸浸”前先将铜矿粉碎的目的是__。该过程生成蓝色溶液和浅黄色沉淀,则反应的化学反应方程式为__;
(2)“溶解”时所用硫酸浓度为0.3mol·L-1,配制1L此硫酸溶液,需要98%、1.84g·mL-1浓硫酸__mL(保留1位小数)。溶解时反应的离子方程式__;
(3)“反应”时,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
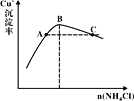
①反应的氧化产物是___,n(氧化剂):n(还原剂)=___;
②比较c(Cu+)相对大小:A点___C点(填“>”、“<”或“=”)。
③提高处于C点状态的混合物中Cu+沉淀率措施是___;
(4)“过滤”所得滤液中溶质主要成分的化学式为__;
(5)不能用硝酸代替硫酸进行“酸洗”,理由是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com