
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
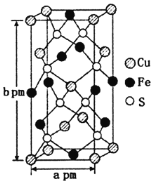
【答案】sp3 1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1 NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应 配位键 N 平面正方形 4 CuFeS2 ![]()
【解析】
(1)根据晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构判断;Ga是31号元素,根据能量最低原理书写核外电子排布式;
(2)①氨气分子与水分子之间形成氢键,且氨气能与水反应;
②Cu2+含有空轨道,NH3中N原子含有孤电子对;
③[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;
(3)根据均摊法计算晶胞中各原子数目,确定化学式,进而计算晶胞质量,再根据![]() 计算晶胞密度。
计算晶胞密度。
(1)因晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构,所以晶体硅中Si原子的杂化方式为sp3杂化。Ga位于周期表中第4周期第ⅢA族,则基态Ga原子的核外电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,故答案为:sp3;1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(2)①NH3极易溶于水,除因为它们都是极性分子外,还因为:NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应,故答案为:NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应;
②Cu2+含有空轨道,NH3中N原子含有孤电子对,二者形成配位键,故答案为:配位键;N;
③[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,故答案为:平面正方形;
(3)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×![]() +4×
+4×![]() =4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×
=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×![]() +1+8×
+1+8×![]() =4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量m=![]() ×4g,晶胞体积V=(a×10-10cm)2×b×10-10cm,
×4g,晶胞体积V=(a×10-10cm)2×b×10-10cm,
晶体密度ρ=(![]() ×4g)÷[(a×10-10cm)2×b×10-10cm]=
×4g)÷[(a×10-10cm)2×b×10-10cm]=![]() gcm3,
gcm3,
故答案为:4;CuFeS2;![]() 。
。


科目:高中化学 来源: 题型:
【题目】(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4![]() N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
A.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1
B.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2
C.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3
D.从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中错误的是( )
A.三联苯(![]() )的一氯代物有4种
)的一氯代物有4种
B.立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有3种
)经硝化可得到六硝基立方烷,其可能的结构有3种
C.β-月桂烯(![]() )与溴发生1:1加成反应,产物(不考虑顺反异构)有3种
)与溴发生1:1加成反应,产物(不考虑顺反异构)有3种
D.酯类化合物C4H8O2在酸性条件下水解得到的醇可能有4种不同结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由其中两种上述元素组成的化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
A.原子半径:Y>Z>W>X
B.简单气态氢化物的热稳定性:Z>Y
C.物质M具有漂白性
D.Q既能与强酸溶液反应,又能与强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是( )

A.F表示反应生成Cu的物质的量
B.E表示反应实际消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是 ( )
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ· mol-1,则氢气的燃烧热ΔH=-241.8 kJ· mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:下表数据可以计算出![]() (g)+3H2(g)
(g)+3H2(g)![]()
![]() (g)的焓变
(g)的焓变
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2(g)时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2(g)所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。

(1)在右图装置中,观察到装置甲铜电极上产生大量的无色气体; 而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论是__________________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____________________________________。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr (Ⅲ) 常见的处理方法是电解法和铁氧磁体法。
①电解法: 将含Cr2O72- 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl 进行电解,使阳极生成的Fe2+和Cr2O72- 发生反应,其离子方程式为_______________。阴极上Cr2O72- 、H+、Fe3+都可能放电。若Cr2O72- 放电,则阴极的电极反应式为_________; 若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀,已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-,则阴极区溶液pH 的范围为_________。
CrO2-,则阴极区溶液pH 的范围为_________。
②铁氧磁体法: 在含Cr (Ⅵ) 的废水中加入绿矾,在pH<4时发生反应使Cr (Ⅵ) 转化为Cr (Ⅲ),调节溶液pH 为6~8,使溶液中的Fe (Ⅱ)、F e(Ⅲ)、Cr (Ⅲ)析出组成相当于Fe(Ⅱ) [Fe(Ⅲ)x·Cr (Ⅲ)2-x] O4(铁氧磁体) 的沉淀,则铁氧磁体中x=_________; 若废水中Cr (Ⅵ) 以CrO3计,用该法除去废水中的Cr (Ⅵ),加入的FeSO4·7H2O 与CrO3的质量比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com