
����Ŀ����ͼ��ʾ�����м׳ص��ܷ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O����˵����ȷ���ǣ� �� 
A.�׳��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ҡ������ǻ�ѧ��ת�����ܵ�װ��
B.�׳�ͨ��CH3OH�ĵ缫��ӦΪCH3OH��6e��+2H2O=CO32��+8H+
C.��Ӧһ��ʱ������ҳ��м���һ����Cu��OH��2���壬��ʹCuSO4��Һ�ָ���ԭŨ��
D.�׳�������560mL����״���£�O2 �� ��ʱ������������������2.9g����
���𰸡�D
���������⣺A���׳���ȼ�ϵ�أ��ҳغͱ�������ӵ�Դ���ڵ��أ����Լ׳��ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã��ҳغͱ����ǰѵ���ת��Ϊ��ѧ�ܵ�װ�ã���A����B��ȼ�ϵ���У�Ͷ��ȼ�ϵĵ缫�Ǹ�����������ȼ��ʧȥ���ӷŵ�������Ӧ���缫��ӦʽΪCH3OH��6e��+8HO��=CO32��+6H2O����B����
C���׳���Ͷ�ż״��ĵ缫�Ǹ�����Ͷ�������ĵ缫�������������ҳ���ʯī�����������������������ʱ��ʯī������������������������ͭ������Ҫ��ʹCuSO4��Һ�ָ���ԭŨ��Ӧ���������������������ͭ����C����
D���׳�������560mL����״���£�O2 �� ת�Ƶ���0.1mol������ת�Ƶ����غ�֪������������0.05mol������ͬʱ����0.1mol���������ӣ����������Ӻ�þ��������������þ����������������þ���������ʵ�����0.05mol��������þ����������=0.05mol��58g/mol=2.9g����D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BaCl2xH2O����;�㷺�Ļ���������Ʒ���ҹ�Ŀǰ��Ҫ�������������������Mg2+��Fe3+�ȣ���Ӧ����BaCl2xH2O������������ͼ��ʾ����ش�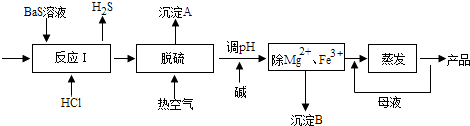
��֪������ʱKsp[Mg��OH��2]=1.8��10��11 Ksp[Fe��OH��3]=4.0��10��38
��1����ӦI�����ɵ�H2S��������ˮ���գ�һ����������������Һ��ͨ�˿������ֿɵõ�������ʹ����Һ������������Ӧ�Ļ�ѧ����ʽΪ ��
��2�������Ȼ�����Һ�к����H2S��HS���ȣ�Ӱ���Ʒ�������ɹ���Ԥ�Ⱥ�Ŀ���������Ԥ�ȿ�����Ŀ����������A����Ҫ�ɷ��� ��
��3���ȿ�������ʱ���в���HS��ת��ΪS2O32�� �� ʹ��Ʒ�Բ��ܴﵽ����Ҫ�������ữ�����ữ����ʱ�����ӷ���ʽΪ ��
��4������ʱ��ΪʹMg2+��Fe3+��ȫ����������Һ������Ũ��С��1��l05molL��1ʱ��Ϊ��������ȫ��������Ӧ����Һ��pH������ֻ����ʽ�����ϣ�
��5��ʵ���Ҳⶨ��Ʒ��x�IJ������£�
��ȷ��ȡ12.23gBaCl2xH2O��Ʒ������l00mLϡ��������ܽ⣻
�ڱ߽��裬����μ���0��lmolL��1H2SO4��Һ����BaSO4��ȫ���������ˣ�������ϴ�ӳ���2��3�Σ�
�۽�������ָ�������������Ϊ11.65g��
����BaSO4�����Ƿ�ϴ�Ӹɾ��ķ�������������x����ֵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ�����Ʒ��������̼��ء�����غͲ�����ˮ�����ʣ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ����������ˮ�У���ֽ������ˣ��ٽ���Һ����ͼ��ʾ������в���������˵����ȷ���ǣ� �� 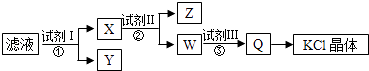
A.ͼʾ�IJ����б���Ҫ����2�ι��˲���
B.��ʼ��Һ������
C.�Լ���ΪNa2CO3��Һ
D.�Լ���Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ȡSO2����֤SO2ijЩ���ʵ�װ��ͼ
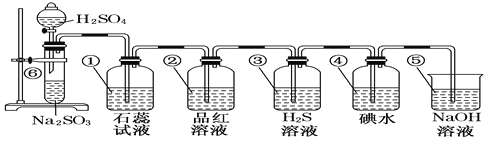
�Իش�
��1�����з�����Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��2�����е�ʵ������Ϊ________________________________________________��
��3���۲쵽���е�Ʒ����Һ________��֤��SO2��________��
��4���۲쵽���е�H2S��Һ________��֤��SO2��_____________��
��5���۲쵽���еĵ�ˮ________��֤��SO2��________��
��6������NaOH��Һ��������_________���йط�Ӧ�Ļ�ѧ����ʽΪ��_________________���˷�Ӧ˵��SO2��________������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�ϣ����й��Ʊ�;����������ͼ��ʾ������˵����ȷ���ǣ� �� 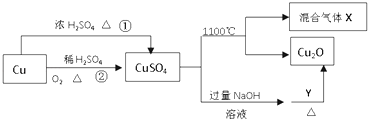
A.�����;���٣�;���ڸ��õ���������ɫ��ѧ˼��
B.Y������������Һ
C.CuSO4��1100��ֽ���������X������SO2��SO3�Ļ������
D.��CuSO4��Һ��������ȴ���ᾧ�����Ƶõ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ�����Ʒ��������̼��ء�����غͲ�����ˮ�����ʣ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ����������ˮ�У���ֽ������ˣ��ٽ���Һ����ͼ��ʾ������в���������˵����ȷ���ǣ� �� 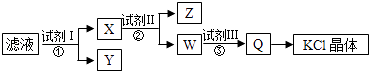
A.ͼʾ�IJ����б���Ҫ����2�ι��˲���
B.��ʼ��Һ������
C.�Լ���ΪNa2CO3��Һ
D.�Լ���Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����������;�㷺�Ľ�������ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ����ս���ͭ����������ͼ�ף���֪���������ʳ�����pH�����
Fe3+ | Cu2+ | Cr3+ | |
��ʼ����pH | 2.1 | 4.7 | 4.3 |
��ȫ����pH | 3.2 | 6.7 | a |
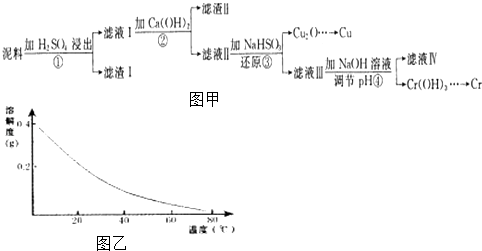
CaSO4���ܽ��������ͼ�ң���ش��������⣺
��1����ҺI������������Ҫ�����ѧʽ����
��2���ڢڲ������У��ȼ���Ca��OH��2������Һ��pH�����ڷ�ΧΪ �� Ȼ����Һ������80����ȹ��ˣ�����������ijɷ�Ϊ ��
��3���ڢ۲������У����ֳ�������ש��ɫ�����⣬����������ɫ�̼�����ζ�����壮д���ò����з�����Ӧ�����ӷ���ʽ
��4��������Ũ�ȡ�1��10��5molL��1lʱ��������Ϊ���ӳ�����ȫ���ڢܲ������У���ҪʹCr3+��ȫ����������������Һ��a����СֵΪ �� ����֪Kap[Cr��OH��3]=6.3��10��31 �� ![]() ��4.0��lg4=0.6��
��4.0��lg4=0.6��
��5��Cr��OH��3���ȷֽ�ΪCr2O3 �� �����ȷ�����ұ����������д�����ȷ������Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֬�ް�סԼ0.2g�������Ʒ�ĩ������ʯ�����ϣ�����֬���ϵ�ˮ���۲쵽��֬����ȼ��������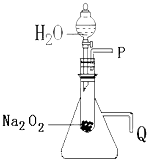
��1��������ʵ���������Ƴ��Ľ����ǣ���һ�����������ɣ��ڶ��� �� Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��2��ij�о���ѧϰС��������ͼ��ʾװ�ã����������ã�����ʵ�飬��֤���������ۣ���������֤��һ�����۵�ʵ������������ǣ�
��������֤�ڶ������۵�ʵ������������ǣ�
��3��ʵ�飨2�����Թ��м�ˮ��������ȫ�ܽ��Ҳ������������ɺ����̪��Һ��������Һ�ȱ�����ɫ��Ϊ̽����ԭ��С��ͬѧ�Ӳ����й������е�֪��Na2O2��ˮ��Ӧ������H2O2 �� H2O2����ǿ�����Ժ�Ư���ԣ��������һ���Ƕȣ���������ʹ�����ָʾ�������һ����ʵ�飬��֤Na2O2������ˮ��ַ�Ӧ�����Һ����H2O2���ڣ� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com