
����Ŀ��BaCl2xH2O����;�㷺�Ļ���������Ʒ���ҹ�Ŀǰ��Ҫ�������������������Mg2+��Fe3+�ȣ���Ӧ����BaCl2xH2O������������ͼ��ʾ����ش�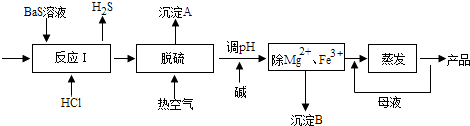
��֪������ʱKsp[Mg��OH��2]=1.8��10��11 Ksp[Fe��OH��3]=4.0��10��38
��1����ӦI�����ɵ�H2S��������ˮ���գ�һ����������������Һ��ͨ�˿������ֿɵõ�������ʹ����Һ������������Ӧ�Ļ�ѧ����ʽΪ ��
��2�������Ȼ�����Һ�к����H2S��HS���ȣ�Ӱ���Ʒ�������ɹ���Ԥ�Ⱥ�Ŀ���������Ԥ�ȿ�����Ŀ����������A����Ҫ�ɷ��� ��
��3���ȿ�������ʱ���в���HS��ת��ΪS2O32�� �� ʹ��Ʒ�Բ��ܴﵽ����Ҫ�������ữ�����ữ����ʱ�����ӷ���ʽΪ ��
��4������ʱ��ΪʹMg2+��Fe3+��ȫ����������Һ������Ũ��С��1��l05molL��1ʱ��Ϊ��������ȫ��������Ӧ����Һ��pH������ֻ����ʽ�����ϣ�
��5��ʵ���Ҳⶨ��Ʒ��x�IJ������£�
��ȷ��ȡ12.23gBaCl2xH2O��Ʒ������l00mLϡ��������ܽ⣻
�ڱ߽��裬����μ���0��lmolL��1H2SO4��Һ����BaSO4��ȫ���������ˣ�������ϴ�ӳ���2��3�Σ�
�۽�������ָ�������������Ϊ11.65g��
����BaSO4�����Ƿ�ϴ�Ӹɾ��ķ�������������x����ֵΪ ��
���𰸡�
��1��2��NH4��2S+O2+2H2O=4NH3?H2O+2S��
��2�������¶ȣ���С��������Һ�е��ܽ�ȣ����ڴ������⣻��
��3��S2O32��+2H+=S��+SO2 ��+H2O
��4��![]()
��5��ȡ�����һ��ϴ��Һ�����������ữ����������Һ��������Һ����ϴ�Ӹɾ���2
���������⣺��1��H2S��������ˮ���գ���������泥������е������ܽ�������������ʣ���Ӧ�Ļ�ѧ����ʽΪ2��NH4��2S+O2+2H2O=4NH3H2O+2S����
���Դ��ǣ�2��NH4��2S+O2+2H2O=4NH3H2O+2S������2��Ԥ�Ⱥ�Ŀ�����ʹ��Һ�¶����ߣ��Ӷ���С��������Һ�е��ܽ�ȣ����ڴ������⣬ͬʱ���������������ܽ������������������ʶ��γɳ��������Դ��ǣ������¶ȣ���С��������Һ�е��ܽ�ȣ����ڴ������⣻��3��S2O32�������������·�������������ԭ��Ӧ���ɶ�����������ʣ���Ӧ�����ӷ���ʽΪS2O32��+2H+=S��+SO2 ��+H2O�����Դ��ǣ�S2O32��+2H+=S��+SO2 ��+H2O����4������Ksp[Mg��OH��2]=1.8��10��11��֪��ҪʹMg 2+������ȫ����Һ��c��OH����= ![]() mol/L=
mol/L= ![]() mol/L����PHֵΪ
mol/L����PHֵΪ ![]() ������Ksp[Fe��OH��3]=4.0��10��38ҪʹFe 3+������ȫ����Һ��c��OH����=
������Ksp[Fe��OH��3]=4.0��10��38ҪʹFe 3+������ȫ����Һ��c��OH����= ![]() mol/L=
mol/L= ![]() mol/L�����Ե�Mg 2+������ȫʱFe 3+���ѳ�����ȫ������Ӧ����Һ��pH����
mol/L�����Ե�Mg 2+������ȫʱFe 3+���ѳ�����ȫ������Ӧ����Һ��pH���� ![]() ���ϣ�
���ϣ�
���Դ��ǣ� ![]() ����5��BaSO4�����ǴӺ��������ӵ���Һ�������ģ����Կ���ͨ��������������Ƿ����������жϳ���ϴ���Ƿ�ɾ�������Ϊȡ�����һ��ϴ��Һ�����������ữ����������Һ��������Һ����ϴ�Ӹɾ����������е�������ݿ�֪��12.23gBaCl2xH2O��Ʒ������BaSO4��������Ϊ11.65g��
����5��BaSO4�����ǴӺ��������ӵ���Һ�������ģ����Կ���ͨ��������������Ƿ����������жϳ���ϴ���Ƿ�ɾ�������Ϊȡ�����һ��ϴ��Һ�����������ữ����������Һ��������Һ����ϴ�Ӹɾ����������е�������ݿ�֪��12.23gBaCl2xH2O��Ʒ������BaSO4��������Ϊ11.65g��
���ݹ�ϵʽBaCl2xH2O��BaSO4
208+18x 233
12.23 11.65![]() ������x=2
������x=2
���Դ��ǣ�ȡ�����һ��ϴ��Һ�����������ữ����������Һ��������Һ����ϴ�Ӹɾ���2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����������KMnO4��H2C2O4��Ӧͨ���ⶨ��λʱ�������� CO2������̽��Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�������
ʵ����� | A ��Һ | B ��Һ |
�� | 20 mL 0.1 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1KMnO4 ������Һ |
�� | 20 mL 0.2 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1 KMnO4������Һ |

��1��������ͼװ�������Ե����㷽��Ϊ�� ��
��2��H2C2O��Һ������ KMnO4��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʵ��̽���������ضԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ͬʱ������Ͳ������CO2�������С��ϵ������ʵ����ţ���
��4����ʵ�����2minĩ�ռ���4.48mL CO2����״���£�������2minĩ��c��MnO4����=����������Һ���ǰ������ı仯����
��5��С��ͬѧ���ַ�Ӧ����������ͼ��ʾ������̽��t1��t2ʱ�������ʱ�����Ҫԭ�������������ǣ�����������K+�Ը÷�Ӧ�д����ã�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ԭ������H -1��O-16���ʣ�
�� H2O��Ħ������Ϊ��_________
�� 36 g ˮ�����ʵ���Ϊ��_____________
�� �������36 ˮ��ȫ�������H2��O2��������H2�ڱ���µ����ԼΪ��______
�� 1. 204��1024��H2O������������ԭ������_____ mol H2O2��������ԭ������ȡ�
�� 1 mol Na2O2���������������ĸ���ԼΪ��_________NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС�����һ�����ԭ�ϣ������ֶ����ڵij�����������Li��Na��Mg��Al��ɵĺϽ��ĩ������̽�������������̽�����森
��̽��Ŀ�ġ�̽�������ԭ�ϵ����
�����ϼ�������Mg2+���鷽����ȡ2�δ���Һ������2��2molL��1NaOH��Һ���ټ���1��þ�Լ�����Ⱦ�ϣ���������ż�������ӣ��������ֳ���������þ�Լ�����Ⱦ�ϳ�����ɫ����ʾ����Һ�к���Mg2+ �� ��Ag+��Cu2+��Fe3+��NH4+�����Mg2+���
��Mg��OH��2������Ũ���Ȼ����Һ�������ij������ܼ��������Ȼ��
�ۺܶ�Ͻ��ǽ����������ȷ���Ļ�ѧ���
��̽��˼·����ȷ�����ԭ�������������ࣻ�ڲⶨ���ԭ�ϵĻ�ѧʽ
��ʵ��̽����
��1����ͬѧ�����˳������飬ʵ�鲽���ʵ���������£�����д�±���
������� | ʵ �� �� �� | ʵ �� �� �� | �� �� |
�� | ȡ���������ԭ�ϼ�����ˮ | ���������� | |
�� | ȡ���������ԭ�ϼ���ϡ���� | ��ȫ�ܽ⣬�д��������������Һ����ɫ |
��2����ͬѧȡ�ڢ���ʵ�����Һ������þ�Լ�����Ⱦ�ϣ��ó��Ͻ��в���þ���ҵĽ�����ѡ���ȷ����������������� ��
��3����ͬѧ���ʵ�鷽����ȷ�����ԭ���еĽ������࣬ʵ���¼���£�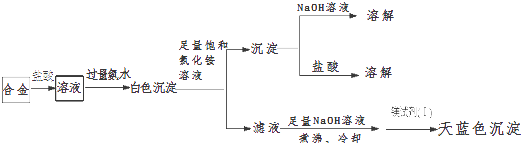
�ɱ���ʵ���¼��֪�������ԭ�����������ֽ�����ɵĺϽ�ʵ������Һ������������������Һ������У���е������� ��
��4����ͬѧ���ñ�ͬѧ�Ľ��ۣ��������ͼ��ʾ��ʵ�鲽�裬ȷ���Ͻ���ɣ�
�������ۣ�
����ȷ���Ͻ���ɵ�������������дѡ����ĸ����
A��m��n B��m��y C��n��y
�����Ͻ������ԭ��������С�Ľ��������ʵ�������Ϊx�����������ʵ���Ϊ7mol��������ͼ������y��x�仯������ ��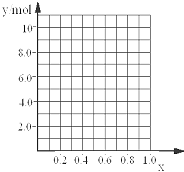
�۵�y=8.5molʱ���úϽ���һ�ֽ���������仯ѧʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��g��+2B��g��C��g��+D��g����H��0��һ���¶��£�2molA��2molB��2L�ܱ������з�Ӧ��10min��ﵽƽ�⣬��ʱ����ѹǿ��Ϊԭ���� ![]() ������������ȷ���ǣ� ��
������������ȷ���ǣ� ��
A.�ӿ�ʼ��ƽ�⣬A�ķ�Ӧ����Ϊ0.08mol?L��1?min��1
B.���ŷ�Ӧ�Ľ��У����������ܶ���С
C.�ﵽƽ��ʱ��B��ת����Ϊ20%
D.���¶��£���Ӧ��ƽ�ⳣ��K= ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��װ�ã����ձ��о�Ϊ��Ӧ��ˮ��Һ��ͨ��һ��ʱ���ü׳���ij�缫��������2.16g���ҳ���ij�缫������0.24gij����������˵����ȷ���ǣ� �� 
A.ij����Һ������Mg��NO3��2��Һ
B.�׳���a�����������������ҳ���d��������ij����
C.�׳���b�����������������ҳ���c��������ij����
D.ij����Һ������CuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A.ʹ��̪���ɫ����Һ�У�Na+��Al3+��SO42����Cl��
B.c��AlO2����=0.1 mol?L��1����Һ�У�Na+��K+��HCO3����Cl��
C.![]() =1��10��13mol?L��1����Һ�У�NH4+��Ca2+��Cl����NO3��
=1��10��13mol?L��1����Һ�У�NH4+��Ca2+��Cl����NO3��
D.ˮ�����c��H+��=1��10��13mol?L��1����Һ�У�K+��Na+��AlO2��CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����м׳ص��ܷ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O����˵����ȷ���ǣ� �� 
A.�׳��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ҡ������ǻ�ѧ��ת�����ܵ�װ��
B.�׳�ͨ��CH3OH�ĵ缫��ӦΪCH3OH��6e��+2H2O=CO32��+8H+
C.��Ӧһ��ʱ������ҳ��м���һ����Cu��OH��2���壬��ʹCuSO4��Һ�ָ���ԭŨ��
D.�׳�������560mL����״���£�O2 �� ��ʱ������������������2.9g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijģ�⡰�˹���Ҷ���绯ѧʵ��װ������ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ��(C3H8O)������˵����ȷ����

A. a�缫�ķ�ӦΪ: 3CO2 + 18H��-18e��= C3H8O+5H2O
B. ��װ�ý���ѧ��ת��Ϊ���ܺ͵���
C. ��װ�ù���ʱH+��b������a����Ǩ��
D. ÿ����1molO2����44gCO2����ԭ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com