
【题目】已知:相对原子量:H -1,O-16,问:
① H2O的摩尔质量为:_________
② 36 g 水的物质的量为:_____________
③ 如果将这36 水完全电解生成H2和O2,则所得H2在标况下的体积约为:______
④ 1. 204×1024个H2O分子所含的氢原子数与_____ mol H2O2所含的氢原子数相等。
⑤ 1 mol Na2O2中所含阴离子数的个数约为:_________NA。
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+ .
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是>> .
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 .
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2 , 同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①写出第二步反应的离子方程式 .
②工业生产时需在反应物中加少量Cl﹣ , 其作用是 .
③生产中会发生副反应ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 .
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2 , 其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置;
②C中应装的试剂为 . C中发生反应的化学方程式为: . 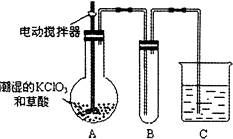
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题:
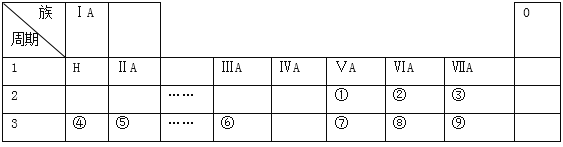
(l)②表示的元素是 ______ (填元素符号).
(2)②③④⑤⑧和⑨这六种元素的简单离子半径由小到大排序为:__________(用离子符号表示);上表所示元素中,非金属性最强的是 ______ (填元素符号);⑦⑧⑨这三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序为:_______________(填分子式)
(3)元素⑨的单质可以用来制取漂白粉,漂白粉的有效成分是 ______ (填化学式);用电子式表示元素⑤与⑨形成化合物的过程 ______ .
(4)上述元素中,单质能与水剧烈反应且水作还原剂,此单质是_________(填化学式)
(5)写出元素④的最高价氧化物对应的水化物与元素⑥的最高价氧化物相互反应的化学方程式 ______ .
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
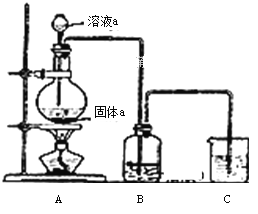
① 装置B中溶液的溶质为______(写化学式).
② 装置C中盛放烧碱稀溶液,目的是______.反应的离子方程式是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.5L的AlCl3溶液中逐滴加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( ) 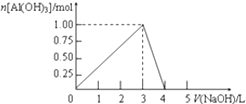
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0 molL﹣1
C.得到39g沉淀时,消耗的NaOH溶液体积一定为1.5 L
D.当V(NaOH)=4.0 L时,得到的溶液中含Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2SO3HSO ![]() +H+的电离平衡常数Kh=1×10﹣2 , 下列说法不正确的足( )
+H+的电离平衡常数Kh=1×10﹣2 , 下列说法不正确的足( )
A.该温度下NaHSO3 的水解平衡常数Kh=1×10﹣2
B.若向NaHSO3 溶液中加入少量的I2 , 则溶液中 ![]() 将减小
将减小
C.略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大
D.NaHSO3溶液中:c(H+)<c(SO ![]() )+c(HSO
)+c(HSO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品.我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如图所示.请回答: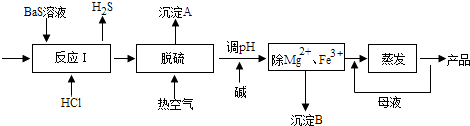
已知:室温时Ksp[Mg(OH)2]=1.8×10﹣11 Ksp[Fe(OH)3]=4.0×10﹣38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为 .
(2)所得氯化钡粗液中含硫化合物(H2S、HS﹣等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是;沉淀A的主要成分是 .
(3)热空气吹除时会有部分HS﹣转变为S2O32﹣ , 使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为 .
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l05molL﹣1时认为该离子完全沉淀),应将溶液的pH调至(只列算式)以上.
(5)实验室测定产品中x的步骤如下:
①准确称取12.23gBaCl2xH2O样品,加入l00mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmolL﹣1H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2﹣3次;
③将沉淀充分干燥后称量,质量为11.65g.
检验BaSO4沉淀是否洗涤干净的方法是;经计算x的数值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品含少量的碳酸钾、硫酸钾和不溶于水的杂质,为了提纯氯化钾,先将样品溶于适量的水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作.下列说法正确的是( ) 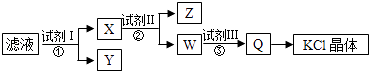
A.图示的步骤中必需要经过2次过滤操作
B.起始滤液呈中性
C.试剂Ⅱ为Na2CO3溶液
D.试剂Ⅲ为盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com