
����Ŀ���±���������ѧ��ѧ�̿�����Ԫ�����ڱ���һ���֣����е�ÿ����ű�ʾһ��Ԫ�أ������Ҫ��ش����⣺
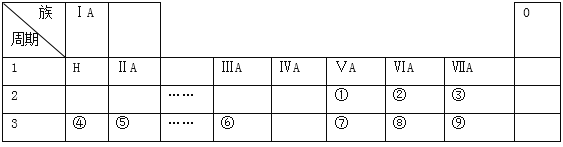
��l���ڱ�ʾ��Ԫ���� ______ ����Ԫ�ط��ţ���
��2���ڢۢܢݢ�͢�������Ԫ�صļ����Ӱ뾶��С��������Ϊ��__________�������ӷ��ű�ʾ�����ϱ���ʾԪ���У��ǽ�������ǿ���� ______ ����Ԫ�ط��ţ����ߢ��������Ԫ�ص�����������Ӧ��ˮ�����������ǿ������˳��Ϊ��_______________�������ʽ��
��3��Ԫ�آ�ĵ��ʿ���������ȡƯ�ۣ�Ư�۵���Ч�ɷ��� ______ ���ѧʽ�����õ���ʽ��ʾԪ�آ�����γɻ�����Ĺ��� ______ ��
��4������Ԫ���У���������ˮ���ҷ�Ӧ��ˮ����ԭ�����˵�����_________���ѧʽ��
��5��д��Ԫ�آܵ�����������Ӧ��ˮ������Ԫ�آ�������������Ӧ�Ļ�ѧ����ʽ ______ ��
��6��ijͬѧΪ�˱Ƚ�Ԫ�آ�͢�ǽ����Ե����ǿ��������ͼ��ʾװ�ý���ʵ�飺
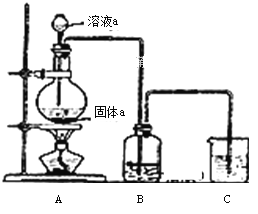
�� װ��B����Һ������Ϊ______��д��ѧʽ����
�� װ��C��ʢ���ռ�ϡ��Һ��Ŀ����______����Ӧ�����ӷ���ʽ��______
���𰸡� O Mg2+ < Na+ < F- < O2- < Cl- < S2- F HClO4 > H2SO4 > H3PO4 Ca��ClO��2 ![]() F2 Al2O3 + 2 NaOH = 2 NaAlO2 + H2O Na2S����H2S�� ���ն����Cl2 Cl2 + 2OH- = Cl- + ClO- + H2O
F2 Al2O3 + 2 NaOH = 2 NaAlO2 + H2O Na2S����H2S�� ���ն����Cl2 Cl2 + 2OH- = Cl- + ClO- + H2O
������������Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���N��O��F��Na��Mg��Al��P��S��Cl����
��l���ڱ�ʾ��Ԫ����O����2�����ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����ڢۢܢݢ�͢�������Ԫ�صļ����Ӱ뾶��С��������ΪMg2+��Na+��F- ��O2-��Cl-��S2-���ϱ���ʾԪ���У��ǽ�������ǿ����F���ǽ�����Խǿ����ۺ����������Խǿ���ߢ��������Ԫ�ص�����������Ӧ��ˮ�����������ǿ������˳��ΪHClO4��H2SO4��H3PO4����3��Ư�۵���Ч�ɷ���Ca��ClO��2��Ԫ�آ�����γɻ��������Ȼ�þ�����γɹ��̿ɱ�ʾΪ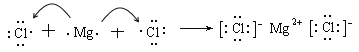 ����4������Ԫ���У���������ˮ���ҷ�Ӧ��ˮ����ԭ����F2����5��Ԫ�آܵ�����������Ӧ��ˮ������Ԫ�آ�������������Ӧ�Ļ�ѧ����ʽΪAl2O3+2NaOH��2NaAlO2+H2O����6����Ҫ��֤��Ԫ�صķǽ�����ǿ��������������������û���Ӧ�жϣ���װ��B����Һ������ΪNa2S��H2S����װ��C��ʢ���ռ�ϡ��Һ��Ŀ�������ն����Cl2����ֹ��Ⱦ��������Ӧ�����ӷ���ʽ��Cl2+2OH-��Cl-+ClO- +H2O��
����4������Ԫ���У���������ˮ���ҷ�Ӧ��ˮ����ԭ����F2����5��Ԫ�آܵ�����������Ӧ��ˮ������Ԫ�آ�������������Ӧ�Ļ�ѧ����ʽΪAl2O3+2NaOH��2NaAlO2+H2O����6����Ҫ��֤��Ԫ�صķǽ�����ǿ��������������������û���Ӧ�жϣ���װ��B����Һ������ΪNa2S��H2S����װ��C��ʢ���ռ�ϡ��Һ��Ŀ�������ն����Cl2����ֹ��Ⱦ��������Ӧ�����ӷ���ʽ��Cl2+2OH-��Cl-+ClO- +H2O��


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Ϊ���о���ѧ��ӦA+B�TC+D�������仯�����ijͬѧ�������ͼ��ʾװ�ã�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ���������Իش��������⣺
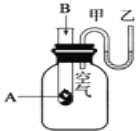
�ٸ÷�ӦΪ__��Ӧ������ȡ������ȡ�����
��A��B����������C��D��������__����ߡ��͡�����
�۷�Ӧ�ﻯѧ���������յ�����__����ߡ��͡����������ﻯѧ���γɷų���������
��2����֪��H2(g)��1/2O2(g)===H2O(g)����Ӧ�����������仯��ͼ��ʾ����
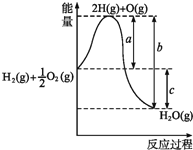
��a��b��c�ֱ����ʲô���壿
a_______________________________________________��
b_______________________________________________��
c_______________________________________________��
�ڸ÷�Ӧ��_________��Ӧ(����ȡ����ȡ�)�� �ų�������Ϊ________kJ(����ĸ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Se�������彡�������һ����Ԫ�ء���֪Se��ԭ�ӽṹʾ��ͼΪ��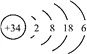 ����˵������ȷ����
����˵������ȷ����
A. ��ԭ�ӵ�������Ϊ34 B. ��Ԫ�ش��ڵ������ڵ���A��
C. SeO2�������������л�ԭ�� D. ���ԣ�HBrO4 > H2SeO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����������KMnO4��H2C2O4��Ӧͨ���ⶨ��λʱ�������� CO2������̽��Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�������
ʵ����� | A ��Һ | B ��Һ |
�� | 20 mL 0.1 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1KMnO4 ������Һ |
�� | 20 mL 0.2 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1 KMnO4������Һ |

��1��������ͼװ�������Ե����㷽��Ϊ�� ��
��2��H2C2O��Һ������ KMnO4��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʵ��̽���������ضԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ͬʱ������Ͳ������CO2�������С��ϵ������ʵ����ţ���
��4����ʵ�����2minĩ�ռ���4.48mL CO2����״���£�������2minĩ��c��MnO4����=����������Һ���ǰ������ı仯����
��5��С��ͬѧ���ַ�Ӧ����������ͼ��ʾ������̽��t1��t2ʱ�������ʱ�����Ҫԭ�������������ǣ�����������K+�Ը÷�Ӧ�д����ã�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ÿ��ת��ͨ��һ����Ӧ����ʵ�ֵ��ǣ� ��
A.S��SO3��H2SO4��SO2
B.N2��NO��NO2��HNO3
C.Na��Na2O��NaOH��Na2CO3
D.Al��Al2O3��Al2��SO4��3��Al��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.KMnO4��Һ�������ữ������H2O2��2MnO ![]() +6H++5H2O2=2Mn2++5O2��+8H2O
+6H++5H2O2=2Mn2++5O2��+8H2O
B.Fe2��SO4��3��Ba��OH��2��Һ��ϣ�Fe3++SO ![]() +Ba2++3OH��=BaSO4��+Fe��OH��3��
+Ba2++3OH��=BaSO4��+Fe��OH��3��
C.����������ʵ���Ũ�ȵ�AlCl3��Ba��OH��2��HCl��Һ��ϣ�3H++Al3++6OH��=Al��OH��3��+3H2O
D.ˮ������ϡ�����ϣ�SiO ![]() +2H+=H2SiO3��
+2H+=H2SiO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�Ͻ�㷺���ں��չ�ҵ�����и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�
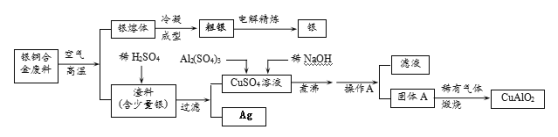
��ע��Al(OH)3��Cu(OH)2�����ֽ�ɶ�Ӧ��������ҿ�ʼ�ֽ���¶ȷֱ�Ϊ450����80����
��1��д��������ϡ���ᷴӦ�Ļ�ѧ����ʽ��________________________��
��2����������A�����Ϊ �� ��
��3������A������Ϊ_______________��
��4������ͭ�Ͻ���ͭ����������Ϊ64%��������5.0 kg�����е�ͭ����ȫת��Ϊ mol CuAlO2��������Ҫ1.0 molL��1��Al2(SO4)3��Һ L��
��5��CuSO4��ҺҲ�������Ʊ��������壬����������� �� �����ˡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ԭ������H -1��O-16���ʣ�
�� H2O��Ħ������Ϊ��_________
�� 36 g ˮ�����ʵ���Ϊ��_____________
�� �������36 ˮ��ȫ�������H2��O2��������H2�ڱ���µ����ԼΪ��______
�� 1. 204��1024��H2O������������ԭ������_____ mol H2O2��������ԭ������ȡ�
�� 1 mol Na2O2���������������ĸ���ԼΪ��_________NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A.ʹ��̪���ɫ����Һ�У�Na+��Al3+��SO42����Cl��
B.c��AlO2����=0.1 mol?L��1����Һ�У�Na+��K+��HCO3����Cl��
C.![]() =1��10��13mol?L��1����Һ�У�NH4+��Ca2+��Cl����NO3��
=1��10��13mol?L��1����Һ�У�NH4+��Ca2+��Cl����NO3��
D.ˮ�����c��H+��=1��10��13mol?L��1����Һ�У�K+��Na+��AlO2��CO32��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com