
����Ŀ����1��Ϊ���о���ѧ��ӦA+B�TC+D�������仯�����ijͬѧ�������ͼ��ʾװ�ã�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ���������Իش��������⣺
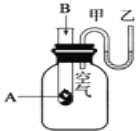
�ٸ÷�ӦΪ__��Ӧ������ȡ������ȡ�����
��A��B����������C��D��������__����ߡ��͡�����
�۷�Ӧ�ﻯѧ���������յ�����__����ߡ��͡����������ﻯѧ���γɷų���������
��2����֪��H2(g)��1/2O2(g)===H2O(g)����Ӧ�����������仯��ͼ��ʾ����
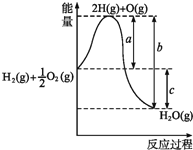
��a��b��c�ֱ����ʲô���壿
a_______________________________________________��
b_______________________________________________��
c_______________________________________________��
�ڸ÷�Ӧ��_________��Ӧ(����ȡ����ȡ�)�� �ų�������Ϊ________kJ(����ĸ��ʾ)
���𰸡� ���� �� �� �ɵĻ�ѧ����������Ҫ������ �µĻ�ѧ���γ����ų������� �ܷ�Ӧ���ų������� ���� c(��b-a)kJ
��������(1)�����ڷ�����ӦA+B�TC+D��U���м״�Һ���½��Ҵ�Һ��������������������������������ʿ����жϸ÷�ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
������A+B�TC+D�ķ�ӦΪ���ȷ�Ӧ������A��B����������C��D���������ߣ��ʴ�Ϊ���ߣ�
�ۻ�ѧ��Ӧ�оɼ����������������¼����ɷų��������÷�ӦΪ���ȷ�Ӧ����Ӧ�ﻯѧ���������յ��������������ﻯѧ���γɷų����������ʴ�Ϊ����
(2)��ͼ�������֪����ѧ��Ӧ����ЧӦʵ���Ƕ��ѻ�ѧ�����յ�������ȥ�γɻ�ѧ���ų�������������a��ʾ�ɵĻ�ѧ����������Ҫ��������b��ʾ�µĻ�ѧ���γ����ų���������c��ʾ�����ܷ�Ӧ���ų����������ʴ�Ϊ���ɵĻ�ѧ����������Ҫ���������µĻ�ѧ���γ����ų����������ܷ�Ӧ���ų���������
�ڷ�Ӧ������������������Ӧ�Ƿ��ȷ�Ӧ���ų�������Ϊc(��b-a)kJ���ʴ�Ϊ�����ȣ�c(��b-a)kJ��


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���У�����ͨ��һ����ѧ��Ӧʵ�ֵ���
A. Fe��Fe3O4B. C��CO2
C. CaO��Ca(OH)2D. S��SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1mol/L�İ�ˮ����ش��������⣺
��1������ˮ�м�����������粒��壬��ʱ��Һ�� ![]() �����������С�����䡱����
�����������С�����䡱����
��2������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ��������Һ��pH7�����������������=�����������ӷ���ʽ��ʾ��ԭ����
��3������ˮ�м���ϡ��������Һ��pH=7����ʱc��NH4+��=amol/l����c��SO ![]() ��=��
��=��
��4������ˮ�м���pH=1�����ᣬ�Ұ�ˮ������������Ϊ1��1����������Һ�и��������ʵ���Ũ���ɴ�С�Ĺ�ϵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У���ѧ����������ͬ���ǣ� ��
A.CaCl2��Na2S
B.Na2O��H2O
C.CO2��NaCl
D.HCl��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ���������ʵ��װ�ò���չ�о������ּг�װ������ȥ����
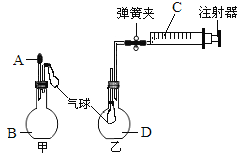
��1������A���������ƿ�۲쵽��ƿ�ϵ���������������A��B�ֱ��������������е�______����ѡ����ţ���
��ϡ�����NaHCO3��Һ ��Ũ�����NaOH��Һ
��NaCl��Һ��KNO3��Һ ������ˮ��NH4NO3����
��2��������C����������ƿ��
�����۲쵽��ƿ�ڵ���������������CΪ����ˮ��������D����Ϊ________������һ�����ʵĻ�ѧʽ����
����CΪO2������DΪNO�����ܹ۲쵽��ƿ�е�������____________________��
��3��������������ͼ��ʾװ�ý���ʵ�顣
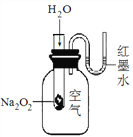
�ٽ�ˮ�����Թܺ��ܹ۲쵽������Ϊ________________��������Ϊ�÷�ӦΪ____________��Ӧ(����ȡ������ȡ�)����Ӧ������������������������____________(��ߡ��͡�����ͬ)����Ӧ�ﻯѧ������ʱ���յ�������________�������ﻯѧ���γ�ʱ�ų�����������
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ_______________________________����Ӧ����������Ҫת����ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺��ʵ��ԭ����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O
��ʵ�����ݼ���¼��
ʵ���� | �����£��Թ��������Լ���������/mL | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
��ش�
��1�����ݱ��е�ʵ�����ݣ����Եõ��Ľ����� ��
��2������ʵ��1�е����ݣ�������KMnO4��ʾ�Ļ�ѧ��Ӧ����Ϊ ��
��3����С��ͬѧ���ݾ��������n��Mn2+����ʱ��仯��������ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n��Mn2+����ʱ��仯��ʵ��������ͼ2��ʾ��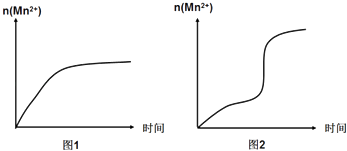
��С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����
�ٸ�С��ͬѧ����ļ����� ��
�����������С��ͬѧ���ʵ�鷽��������д���пհ�
ʵ���� | �����£��Թ��������Լ��������� | �����Թ��м���ij�ֹ��� | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | |||
4 | 2.0 | 2.0 | 3.0 | MnSO4 | t | |
������С��ͬѧ����ļ��������Ӧ�۲쵽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö������ȣ�ClO2���������ƣ�Na2FeO4Ħ������Ϊ166g/mol�������;�ˮ�������ͳ�ľ�ˮ��Cl2�Ե�ˮ���������dz�������ˮ�����¼�����ClO2��Na2FeO4��ˮ���������зֱ𱻻�ԭΪCl����Fe3+ ��
��1������Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���ô��ClO2��Na2FeO4��Cl2��������ɱ����������Ч���ɴ�С��˳�������� ��
��2��Na2FeO4����ˮ��ų�һ����ɫ��ζ���壬��ɱ������������ˮ�е��������ʵ�ԭ���������ӷ���ʽ��ʾΪ ��
��3����ҵ��CH3OH��NaClO3Ϊԭ����������������ȡClO2 �� ͬʱ����CO2���壬��֪�÷�Ӧ��Ϊ�������У���һ��Ϊ2ClO3��+2Cl��+4H+=2ClO2��+Cl2��+2H2O����д���ڶ�����Ӧ�����ӷ���ʽ ��
�ڹ�ҵ����ʱ���ڷ�Ӧ���м�����Cl�� �� �������� ��
�������лᷢ������ӦClO3��+Cl��+H+��Cl2��+H2O��δ��ƽ��������÷�Ӧ��Ļ��������Cl2���������Ϊ3/73������ʼͶ��ʱCH3OH��NaClO3�����ʵ���֮��Ϊ ��
��4����֪����������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�棬�е�Ϊ11.0�棬������ˮ��ClO2Ҳ���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ�����60��ʱ��Ӧ�Ƶã�ijѧ������ͼ��ʾ��װ��ģ�ҵ��ȡ���ռ�ClO2 �� ����AΪClO2�ķ���װ�ã�BΪClO2������װ�ã�CΪβ������װ�ã����ʣ���A���ֻ�Ӧ�����¶ȿ��ƣ���ˮԡ���ȣ�װ�ã�B���ֻ�Ӧ����ʲôװ����
��C��Ӧװ���Լ�Ϊ �� C�з�����Ӧ�Ļ�ѧ����ʽΪ�� �� 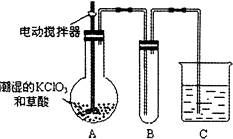
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���������ѧ��ѧ�̿�����Ԫ�����ڱ���һ���֣����е�ÿ����ű�ʾһ��Ԫ�أ������Ҫ��ش����⣺
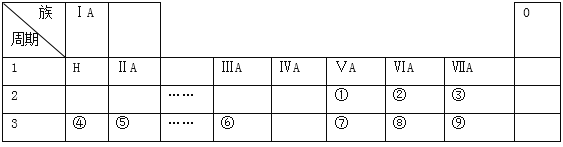
��l���ڱ�ʾ��Ԫ���� ______ ����Ԫ�ط��ţ���
��2���ڢۢܢݢ�͢�������Ԫ�صļ����Ӱ뾶��С��������Ϊ��__________�������ӷ��ű�ʾ�����ϱ���ʾԪ���У��ǽ�������ǿ���� ______ ����Ԫ�ط��ţ����ߢ��������Ԫ�ص�����������Ӧ��ˮ�����������ǿ������˳��Ϊ��_______________�������ʽ��
��3��Ԫ�آ�ĵ��ʿ���������ȡƯ�ۣ�Ư�۵���Ч�ɷ��� ______ ���ѧʽ�����õ���ʽ��ʾԪ�آ�����γɻ�����Ĺ��� ______ ��
��4������Ԫ���У���������ˮ���ҷ�Ӧ��ˮ����ԭ�����˵�����_________���ѧʽ��
��5��д��Ԫ�آܵ�����������Ӧ��ˮ������Ԫ�آ�������������Ӧ�Ļ�ѧ����ʽ ______ ��
��6��ijͬѧΪ�˱Ƚ�Ԫ�آ�͢�ǽ����Ե����ǿ��������ͼ��ʾװ�ý���ʵ�飺
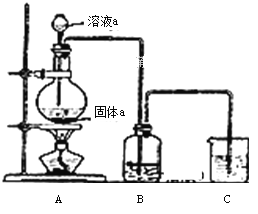
�� װ��B����Һ������Ϊ______��д��ѧʽ����
�� װ��C��ʢ���ռ�ϡ��Һ��Ŀ����______����Ӧ�����ӷ���ʽ��______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com