
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( ) 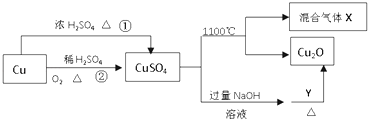
A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是蔗糖溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发、冷却、结晶,可制得胆矾晶体
【答案】AD
【解析】解:A.相对于途径①、③,铜和浓硫酸反应会生成二氧化硫气体污染空气,途径②的优点:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生,更好地体现了绿色化学思想,故A正确;B.葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Y可为葡萄糖,蔗糖是非还原性糖不能和氢氧化铁反应生成氧化亚铜,故B错误;
C.硫酸铜分解生成Cu2O与氧气、SO3、SO2 , 根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、氧元素化合价只有降低,无元素化合价升高,故C错误;
D.将CuSO4溶液蒸发浓缩、冷却结晶,过滤洗涤可制得胆矾晶体,故D正确;
故选AD.


科目:高中化学 来源: 题型:
【题目】有关化学反应的方向和速率的研究可以指导化工生产.下列说法正确的是( )
A.N2+3H2 ![]() 2NH3△H<0,在任何温度下均为自发反应
2NH3△H<0,在任何温度下均为自发反应
B.向新制氯水中加入少量小苏打固体可提高其漂白能力
C.1L密闭容器中发生反应4NH3+5O2?4NO+6H2O,充少量 N2可加快反应速率
D.湿法炼铜的反应为Fe+CuSO4=FeSO4+Cu,反应中的Fe可以用Na代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是( ) 
A.某盐溶液可能是Mg(NO3)2溶液
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.甲池是b极上析出金属银,乙池是c极上析出某金属
D.某盐溶液可能是CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A.3.4gNH3中含有电子数为2NA
B.0.1mol/L CuSO4溶液中含有的SO ![]() 数目为0.1NA
数目为0.1NA
C.常温常压下,2.24L O3中含有的氧原子数为0.3NA
D.足量的MnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O下列说法正确的是( ) 
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH﹣6e﹣+2H2O=CO32﹣+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗560mL(标准状况下)O2 , 此时丙池中理论上最多产生2.9g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机化工原料,需求量巨大.目前我国独创的联醇工艺的核心是采用一氧化碳加氢中压合成法.主要反应如下:CO(g)+2H2(g)═CH3OH(g);△H=﹣111.0kJ/mol另有副反应:2CO+2H2O═CO2+CH4 等;中压法操作:压力为10﹣15MPa,温度控制在513K﹣543K,所用催化剂是CuO﹣ZnO﹣Al2O3 . 合成甲醇的流程如图所示,
请回答:
(1)实际生产中CO不能过量,以免生成羰基铁使催化剂失去活性,而氢气过量是有益的,指出两点理由:、 .
(2)采取10﹣15MPa压力的作用是;温度控制在513K﹣543K的原因是 .
(3)原料气中的H2S对铜催化剂影响甚重,故必先去除之,通常用生石灰除杂,该反应的化学方程式为:
(4)粗甲醇中含有二甲醚等副产物,在常压下蒸馏粗甲醇,首先获得的馏分是(写结构简式);获得的甲醇又可在银催化下氧化成甲醛,该反应的化学方程式为: .
(5)若CO的转化率为80%,当有22.4M3(标况)CO与过量H2充分反应(不计其它副反应),可制得纯度为96%的甲醇的质量为kg,同时获得热量kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3=(用△H1、△H2的代数式表示);推测反应Ⅲ是反应(填“吸热”或“放热”)
(2)相同条件下,反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示. ①计算0~4分钟在A催化剂作用下,反应速率V(NO)= .
②下列说法不正确的是 .
A.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2. ①保持恒温恒容,再充入NO2气体,NO2体积分数(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)2NO2(g);△H2说法正确的是 .
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2 , 平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则下列说法不正确的是

A. N4与N2互为同素异形体
B. 1molN4气体转化为N2时要吸收724kJ能量
C. N4变成N2是化学变化
D. N4分子中有6个共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com