
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则下列说法不正确的是

A. N4与N2互为同素异形体
B. 1molN4气体转化为N2时要吸收724kJ能量
C. N4变成N2是化学变化
D. N4分子中有6个共价键
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一.聚醋酸乙烯酯( PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB.有关合成路线如下图(部分反应条件和产物略去).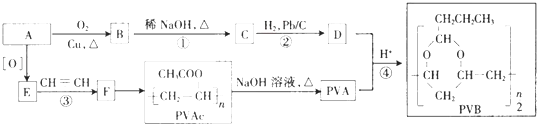
已知:
Ⅰ. ![]()
Ⅱ. 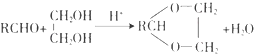
请回答:
(1)A为饱和一元醇,其氧的质量分数约为34.8%,A的化学名称为 , PVA的结构简式为 .
(2)C中官能团的名称是 , A~F中核磁共振氢谱出峰最多的是(填化合 物代号).
(3)反应③的化学方程式为 , 反应类型是;反应④的化学方程式为
(4)PVAc是由F加聚而成,写出两种与F具有相同官能团的同分异构体的结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( ) 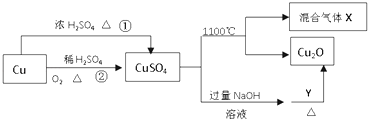
A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是蔗糖溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发、冷却、结晶,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DAP﹣A树脂是一种优良的热固性树脂,被用作高级UV油墨的一种成分.这种材料可采用如下合成路线制备: 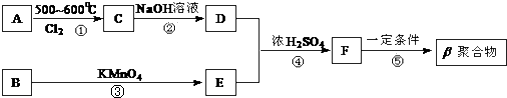 已知:
已知:
Ⅰ. ![]()
![]()
![]()
Ⅱ.β聚合物的结构简式: 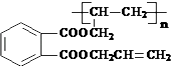
试回答下列问题:
(1)在①~④的反应中属取代反应的是 .
(2)写出反应②的化学方程式 .
(3)写出反应⑤的化学方程式
(4)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是和 .
(5)写出B(C8H10)苯环上的所有二氯代物结构简式: , 其中核磁共振氢谱只有两组峰,且峰面积比为3:1的有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图甲,已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
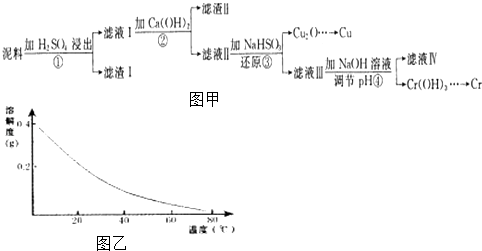
CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1×10﹣5molL﹣1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2Fe2++Br2=2Fe3++2Br﹣ , 向10mL0.1molL﹣1 的FeBr2溶液中通入0.001mol Cl2 , 反应后的溶液中,除含有Cl﹣外还一定( )
A.含Fe2+ , 不含Fe3+
B.含Fe3+ , 不含Br﹣
C.含Fe3+ , 含Br﹣
D.含Fe2+ , 含Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ/mol)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ/mo1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3
2NH3
(1)断开1molN2中的化学键需_______(填“吸收”或“放出”)_____kJ能量;
(2)形成2molNH3中的化学键需_______(填“吸收”或“放出”)__kJ能量;
(3)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为_____kJ。根据上表中的数据判断工业合成氨的反应是_______(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用含少量SiO2、Al2O3的铬铁矿(FeO·Cr2O3)冶炼铬,简要流程如下:
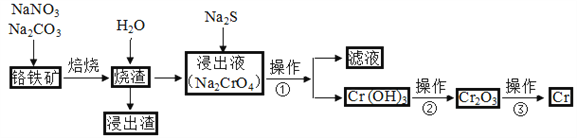
(1)完成下列化学方程式(在横线上填写物质的化学式及计量数):
2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+________。
4Na2CrO4+Fe2O3+4CO2↑+________。
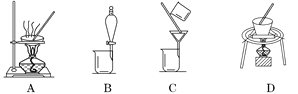
(2)操作①包括过滤与洗涤,在实验室中进行洗涤沉淀的操作是_____________________;操作②可选用的装置(部分夹持装置略去)是________(填序号)。
(3)写出能够完成操作③的相关反应的化学方程式:__________________________________。
(4)化学需氧量(COD)可度量水遭受有机物污染的程度。在强酸并加热的条件下,用K2Cr2O7作强氧化剂处理水样,并测定消耗的K2Cr2O7的量,然后换算成相当于O2的含量称为化学需氧量(以mg·L-1计)。化学兴趣小组测定某水样的化学需氧量(COD)过程如下:
a.取a mL水样置于锥形瓶中,加入10.00 mL 0.2500 mol·L-1的K2Cr2O7溶液。
b.……
c.加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O![]() 转化为Cr3+)。
转化为Cr3+)。
①计算该水样的化学需氧量时需用到下列关系:要除去1 mol Cr2O![]() 需消耗_______ mol Fe2+,1 mol Cr2O
需消耗_______ mol Fe2+,1 mol Cr2O![]() 相当于________mol O2。
相当于________mol O2。
②该废水中加入硫酸亚铁铵和稀硫酸,发生反应的离子方程式为______________________。
③若用硫酸亚铁铵[(NH4)2Fe(SO4)2]处理该含铬(Cr2O![]() )废水过程中,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述正确的是____。
)废水过程中,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述正确的是____。
a.消耗硫酸亚铁铵的物质的量为1.5nmol
b.处理废水中的Cr2O72-的物质的量为0.25nmol
c.反应中发生转移的电子数为3nxmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,①~⑨是元素周期表中的部分元素。
ⅠA | 0 | |||||||
① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
…… | ② | ③ | ④ | |||||
⑤ | ⑥ | …… | ⑦ | ⑧ | ⑨ | |||
请回答下列问题:
(1)⑥的元素符号是_______ ,⑦的离子结构示意图 _______________________,原子半径⑤______⑥(填“>”或“<”)。
(2)元素②③④的气态氢化物中最稳定的是______________(填化学式)。
(3)元素⑤的最高价氧化物对应的水化物与元素⑨的氢化物的水溶液发生反应的离子方程式是_________________________________。
(4)元素①和②形成的化合物的电子式是_____________________。
(5)元素非金属性⑧_______⑨(填“>”或“<”)。
(6)已知元素⑧的原子序数为a,则元素③的原子序数可能为___________。
A、a + 8 B、a-8 C、a + 2 D、a-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com