
【题目】工业上常用含少量SiO2、Al2O3的铬铁矿(FeO·Cr2O3)冶炼铬,简要流程如下:
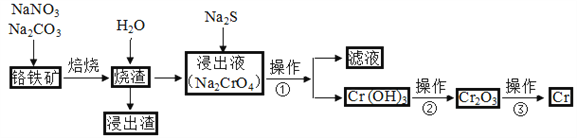
(1)完成下列化学方程式(在横线上填写物质的化学式及计量数):
2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+________。
4Na2CrO4+Fe2O3+4CO2↑+________。
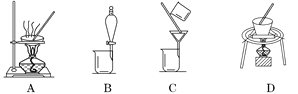
(2)操作①包括过滤与洗涤,在实验室中进行洗涤沉淀的操作是_____________________;操作②可选用的装置(部分夹持装置略去)是________(填序号)。
(3)写出能够完成操作③的相关反应的化学方程式:__________________________________。
(4)化学需氧量(COD)可度量水遭受有机物污染的程度。在强酸并加热的条件下,用K2Cr2O7作强氧化剂处理水样,并测定消耗的K2Cr2O7的量,然后换算成相当于O2的含量称为化学需氧量(以mg·L-1计)。化学兴趣小组测定某水样的化学需氧量(COD)过程如下:
a.取a mL水样置于锥形瓶中,加入10.00 mL 0.2500 mol·L-1的K2Cr2O7溶液。
b.……
c.加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O![]() 转化为Cr3+)。
转化为Cr3+)。
①计算该水样的化学需氧量时需用到下列关系:要除去1 mol Cr2O![]() 需消耗_______ mol Fe2+,1 mol Cr2O
需消耗_______ mol Fe2+,1 mol Cr2O![]() 相当于________mol O2。
相当于________mol O2。
②该废水中加入硫酸亚铁铵和稀硫酸,发生反应的离子方程式为______________________。
③若用硫酸亚铁铵[(NH4)2Fe(SO4)2]处理该含铬(Cr2O![]() )废水过程中,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述正确的是____。
)废水过程中,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述正确的是____。
a.消耗硫酸亚铁铵的物质的量为1.5nmol
b.处理废水中的Cr2O72-的物质的量为0.25nmol
c.反应中发生转移的电子数为3nxmol
【答案】 7NaNO2 向漏斗中加入蒸馏水至浸没固体,让液体自由留下,重复2—3次 D Cr2O3 + 2Al![]() 2Cr +Al2O3(电解Cr2O3 也可) 6mol 1.5mol 6Fe2++Cr2O72-+14H+=2Cr3++7H2O+6Fe3+ bc
2Cr +Al2O3(电解Cr2O3 也可) 6mol 1.5mol 6Fe2++Cr2O72-+14H+=2Cr3++7H2O+6Fe3+ bc
【解析】(1)根据反应前后元素的化合价变化可知,反应前铁元素的化合价从+2价升高到+3价,失去1个电子。Cr元素的化合价从+3价升高到+6价,失去3个电子,而O、Na、C的化合价均没有变化,所以根据电子的得失守恒可知,氮元素的化合价一定降低。由于铁元素共失去2个电子,Cr元素共失去12个电子,因此7个氮原子得到14个电子,则氮元素的化合价从+5价降低到+3价,所以还原产物是NaNO2,反应的离子方程式为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。(2)过滤后的沉淀洗涤是在过滤器中完成的,所以在实验室中进行洗涤沉淀的操作是向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次;操作②是Cr(OH)3分解生成Cr2O3,固体加热分解在坩埚中进行,A是蒸发,B是分液,C是过滤,因此答案选D;(3)Cr元素是高熔点金属,可以通过铝热反应或电解法冶炼,反应的方程式分别为Cr2O3+2Al
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。(2)过滤后的沉淀洗涤是在过滤器中完成的,所以在实验室中进行洗涤沉淀的操作是向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次;操作②是Cr(OH)3分解生成Cr2O3,固体加热分解在坩埚中进行,A是蒸发,B是分液,C是过滤,因此答案选D;(3)Cr元素是高熔点金属,可以通过铝热反应或电解法冶炼,反应的方程式分别为Cr2O3+2Al![]() 2Cr+Al2O3、2Cr2O3
2Cr+Al2O3、2Cr2O3![]() 4Cr+3O2↑。(4)①K2Cr2O7在氧化还原反应中Cr元素的化合价从+6价降低到+3价,得到3个电子,而亚铁离子中铁元素的化合价从+2价升高到+3价,失去3个电子,因此根据电子得失守恒可知,除去1molCr2O72-需消耗6molFe2+,由于1mol氧气做氧化剂得到4mol电子,所以1molCr2O72-相当于1.5molO2;②该废水中加入硫酸亚铁铵和稀硫酸,发生反应的离子方程式为6Fe2++Cr2O72-+14H+=2Cr3++7H2O+6Fe3+。③FeOFeyCrxO3中Cr为正三价,由化合物中正负化合价的代数和为0可知,3y+3x=6,则x=2-y,由得失电子守恒知y=3x,则x=0.5、y=1.5。a.由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1)mol=2.5nmol,a错误;b.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为0.5nxmol=0.25nmol,b正确;c.得到nmolFeOFeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,c正确;答案选bc。
4Cr+3O2↑。(4)①K2Cr2O7在氧化还原反应中Cr元素的化合价从+6价降低到+3价,得到3个电子,而亚铁离子中铁元素的化合价从+2价升高到+3价,失去3个电子,因此根据电子得失守恒可知,除去1molCr2O72-需消耗6molFe2+,由于1mol氧气做氧化剂得到4mol电子,所以1molCr2O72-相当于1.5molO2;②该废水中加入硫酸亚铁铵和稀硫酸,发生反应的离子方程式为6Fe2++Cr2O72-+14H+=2Cr3++7H2O+6Fe3+。③FeOFeyCrxO3中Cr为正三价,由化合物中正负化合价的代数和为0可知,3y+3x=6,则x=2-y,由得失电子守恒知y=3x,则x=0.5、y=1.5。a.由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1)mol=2.5nmol,a错误;b.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为0.5nxmol=0.25nmol,b正确;c.得到nmolFeOFeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,c正确;答案选bc。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A.3.4gNH3中含有电子数为2NA
B.0.1mol/L CuSO4溶液中含有的SO ![]() 数目为0.1NA
数目为0.1NA
C.常温常压下,2.24L O3中含有的氧原子数为0.3NA
D.足量的MnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则下列说法不正确的是

A. N4与N2互为同素异形体
B. 1molN4气体转化为N2时要吸收724kJ能量
C. N4变成N2是化学变化
D. N4分子中有6个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气的成分有多种,乙酸苯甲酯( ![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
(1)写出反应①的化学方程式: .
(2)反应③的反应类型为 .
(3)C的结构简式为 .
(4)反应①~③中,原子的理论利用率为100%,符合绿色化学要求的是(填序号).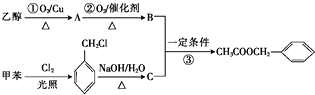
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )

A. 向溶液B中滴加KSCN溶液,溶液一定不会变红色
B. 溶液A转化为溶液B发生反应的离子方程式为:2Fe3++2H2O+SO2===2Fe2++SO![]() +4H+
+4H+
C. 溶液酸性:B>C>A
D. 加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的浓度关系正确的是( )
A.c(NH ![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO﹣)=c(HCO ![]() )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO ![]() )
)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表对某些反应方程式的评价合理的是( )
编号 | 离子方程式或电极反应式 | 评价 | |
A | 次氯酸钙溶液中通入足量SO2 | Ca2++ClO﹣+SO2+H2O=CaSO4+Cl﹣+2H+ | 正确 |
B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO | 正确 |
C | 醋酸铵溶于水 | CH3COO﹣+NH | 错误,阴离子水解相互促进,应该用“=”号 |
D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e﹣=2Cu | 错误,该阴阳两极反应不可能同时发生 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com