
【题目】不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl2H2O中Cr3+的配位数为___。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____。
③氨是___分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___,氨的沸点高于PH3,原因是___。
(3)镍元素基态原子的价电子排布式为___,3d能级上的未成对电子数为___。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___。
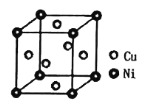
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___nm。
【答案】![]() 6 正四面体 配位键 极性 sp3 氨分子间存在氢键 3d84s2 2 铜失去的第二个电子是全充满的3d10电子,镍失去的是4s1电子
6 正四面体 配位键 极性 sp3 氨分子间存在氢键 3d84s2 2 铜失去的第二个电子是全充满的3d10电子,镍失去的是4s1电子 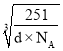 ×107
×107
【解析】
(1)基态碳原子的排布式为1s22s22p2;
(2)①[Cr(H2O)4Cl2]Cl2H2O中Cr3+与4个H2O,2个Cl-形成配位键;
②利用价层电子互斥理论判断;
③氨中氮原子为sp3杂化,氨分子间存在氢键;
(3)镍元素为28号元素,其基态原子的价电子排布式3d84s2;
(4)铜失去的第二个电子是全充满的3d10电子,而镍失去的是4s1电子;
(5)根据ρ=![]() 计算。
计算。
(1)基态碳原子的排布式为1s22s22p2,则排布图为![]() ;
;
(2)①[Cr(H2O)4Cl2]Cl2H2O中Cr3+与4个H2O,2个Cl-形成配位键,所以配位数为6;
②[Ni(NH3)6]SO4中阴离子为硫酸根离子,其中心S原子孤电子对数=![]() (a-bx)=
(a-bx)=![]() (6+2-2×3)=0,无孤电子对,4条化学键,为sp3杂化,故立体构型是正四面体;配离子中Ni2+与NH3之间形成的为配位键;
(6+2-2×3)=0,无孤电子对,4条化学键,为sp3杂化,故立体构型是正四面体;配离子中Ni2+与NH3之间形成的为配位键;
③氨中氮原子为sp3杂化,为三角锥形,则为极性分子;氨分子间存在氢键,而PH3分子间不存在氢键,氨分子间的作用力大于PH3分子间的作用力,导致氨的沸点高于PH3;
(3)镍元素为28号元素,其基态原子的价电子排布式3d84s2,3d能级有5个轨道,8个电子,则未成对电子数为2;
(4)铜失去的第二个电子是全充满的3d10电子,镍失去的是4s1电子,导致ICu>INi;
(5)Cu位于晶胞的面心,N(Cu)= 6×![]() =3,Ni位于晶胞的顶点,N(Ni)= 8×
=3,Ni位于晶胞的顶点,N(Ni)= 8×![]() =1,ρ=
=1,ρ=![]() ,则m=ρV,64×3+59×1=d×(a×10-7)3×NA,a=
,则m=ρV,64×3+59×1=d×(a×10-7)3×NA,a=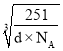 ×107nm。
×107nm。


科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是
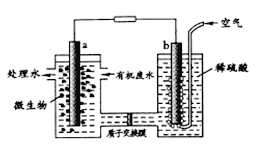
A. a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
B. 质子交换膜处H+由右向左移动
C. 该电池在微生物作用下将化学能转化为电能
D. 开始放电时b极附近pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
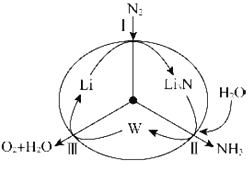
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
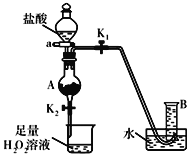
A.烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.B中收集到的气体是氢气
D.反应后的烧杯中通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
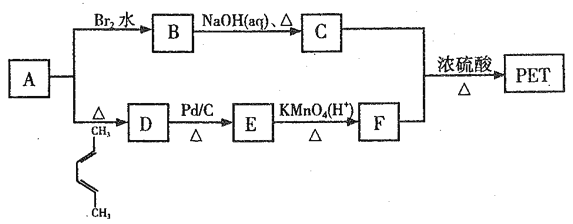
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为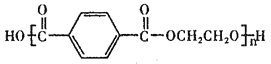 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
已知:①![]() ;②
;②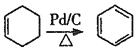 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如右图所示,下列说法中,正确的是
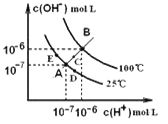
A. 图中A、B、D三点处KW间的关系: B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C. 温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D. 加热浓缩A点所示溶液,可从A点变化到B点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
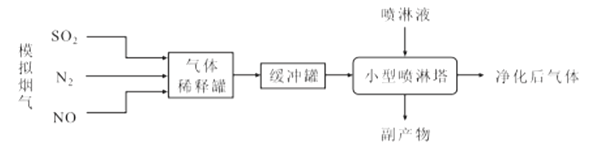
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
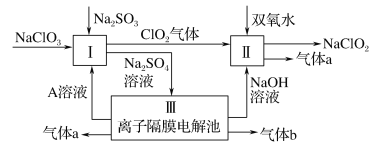
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____。
(3)Ⅲ中离子隔膜电解池的装置如下:
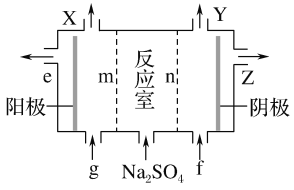
①A的化学式是________,A在____口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com