
【题目】下列说法正确的是( )
A. 合成氨生产中,使用高效催化剂可提高原料平衡转化率
B. 铁质管道与锌用导线相连(如图所示)可防止管道被腐蚀

C. 5 mL 18 mol·L-1浓硫酸与足量铜共热,反应最多转移0.18 mol电子
D. 常温下,反应2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,该反应ΔH>0
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量SO2和NO,某科研小组研究SO2和NO的吸收方法。
回答下列问题:
(1)已知SO2(g)+O3(g) ![]() SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
NO(g)+O3(g) ![]() NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1
则反应SO3(g)+NO(g) ![]() SO2(g)+NO2(g)的△H=________kJ· mol-1
SO2(g)+NO2(g)的△H=________kJ· mol-1
(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g) ![]() NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。
①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=________;若其它条件保持不变,在恒压条件下进行,则平衡时NO的转化率α2________α1(填“>”“<”或“=”)
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向________(填“正”或“逆”)方向移动
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是________,t6时刻改变的条件是________,t4时刻改变条件后v(正) ________v(逆)(填“>”“<”或“=”)

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-![]() CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
①25℃时,0.1mol·L-1(NH4)2SO3溶液呈________ (填“酸性”“碱性”或“中性”)。
②计算第2步反应的平衡常数K=________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________,占据最高能级的电子的电子云轮廓图形状为___________,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________。
(3)AlF3具有较高的熔点(1040℃),属于___________晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________,该阴离子中存在的化学键有___________(填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位健 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________。立方体边长为acm,阿伏加德罗常数的值为NA,则CaF2晶体的密度为___________g·cm-3(列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
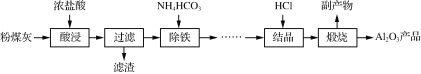
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。

(4)上述流程中,可以循环利用的物质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳原子总数之比为_____,密度之比为_____。
(2)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,则其中CO2为____ mol。
(3)9.03×1023个NH3含___mol氢原子,在标准状况下的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=________。
②已知H2C2O4是二元弱酸。室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,KHC2O4水解平衡常数的数值为____。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.770 0 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.090 0 g。
步骤Ⅱ 准确称取1.770 0 g样品,用NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.050 00 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
消耗EDTA标准溶液 的体积/mL | 25.92 | 24.99 | 25.01 |
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有____(填字母)。
A. 锥形瓶水洗后未干燥
B. 滴定时锥形瓶中有液体溅出
C. 装EDTA标准溶液的滴定管水洗后未润洗
D. 开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(2)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.Vd/(MV+2240) B.1000Vd/(MV+2240) C.1000VdM/(MV+2240) D.MV/22.4(V+0.1)d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14%的KNO3溶液与30.0g质量分数为24%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算:
(1)混合后溶液中KNO3的质量分数为____,物质的量浓度为_____。
(2)在1000g水中需溶解____molKNO3才能使其浓度恰好与上述混合溶液的浓度相等。
(3)标准状况下44.8LHCl溶于水配成500mL溶液。则其浓度为_____,100mL该溶液与足量NaHCO3反应,生成气体在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是放热反应,但不是氧化还原反应的是( )
A. 铝片与稀硫酸的反应B. 氢氧化钡与硫酸的反应
C. 灼热的炭与二氧化碳的反应D. 甲烷在氧气中燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com