
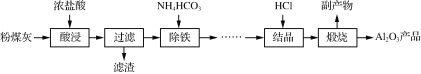
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。

(4)上述流程中,可以循环利用的物质是____。
【答案】Al2O3+6H+===2Al3++3H2O 温度太高,盐酸大量挥发会引起容器内压强过大,导致反应釜损坏 Fe3++3![]() ===Fe(OH)3↓+3CO2↑ 静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色 盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出 HCl(或盐酸)
===Fe(OH)3↓+3CO2↑ 静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色 盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出 HCl(或盐酸)
【解析】
制备Al2O3的流程:粉煤灰的主要成分为Al2O3和SiO2(含少量杂质Fe2O3),加浓盐酸,Al2O3、Fe2O3转化为离子,SiO2不溶于盐酸,过滤,滤渣为SiO2,滤液中含有Al3+、Fe3+,加入适量碳酸氢铵,Fe3+转化为沉淀从而达到除铁的目的,滤液中氯化铝在氯化氢的氛围中加热结晶得AlCl3·6H2O晶体,AlCl3·6H2O晶体煅烧得到Al2O3以及副产品氯化氢,据此分析解答。
制备Al2O3的流程:粉煤灰的主要成分为Al2O3和SiO2(含少量杂质Fe2O3),加浓盐酸,Al2O3、Fe2O3转化为离子,SiO2不溶于盐酸,过滤,滤渣为SiO2,滤液中含有Al3+、Fe3+,加入适量碳酸氢铵,Fe3+转化为沉淀从而达到除铁的目的,滤液中氯化铝在氯化氢的氛围中加热结晶得AlCl3·6H2O晶体,AlCl3·6H2O晶体煅烧得到Al2O3以及副产品氯化氢。
(1)“酸浸”过程发生的主要反应为氧化铝与盐酸反应生成氯化铝和水,反应的离子方程式是Al2O3+6H+=2Al3++3H2O;
“酸浸”在恒容密闭反应釜中进行,温度太高,盐酸大量挥发会引起容器内压强过大,导致反应釜损坏,故温度不宜过高;
(2)“除铁”生成Fe(OH)3是氯化铁与碳酸氢铵发生双水解反应生成氢氧化铁、氯化铵和二氧化碳,反应的离子方程式为Fe3++3HCO![]() =Fe(OH)3↓+3CO2↑,检验溶液中铁元素已经除尽的方法是静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色;
=Fe(OH)3↓+3CO2↑,检验溶液中铁元素已经除尽的方法是静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色;
(3) 盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出,Al3+浓度减小;
(4)上述流程中,结晶时必须用到氯化氢,而副产品为氯化氢,故可以循环利用的物质是HCl(或盐酸)。


科目:高中化学 来源: 题型:
【题目】钴的化合物用途广泛。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2·6H2O粗品的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:_____________________________。
(2)加入NaClO3的作用是______________________________。
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液II”中加入萃取剂的主要目的是___________________,使用萃取剂时最适宜的pH是_____(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C5.0~5.5 D.9.5~9.8

(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11 , Ksp(CaF2)=1.05×10-10 。 当加入过量NaF后,所得滤液c (Mg2+)/c (Ca2+)=________。
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求回答问题:


(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置的字母,下同)
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,水的方向是从________口进水_______口出水。
(4)装置B在分液时打开活塞后,下层液体从________,上层液体从________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A. 含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B. 2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为0.6 mol·L-1
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间发生的化学反应属于吸热反应的是( )
A. 木炭和氧气B. 生石灰和水C. 盐酸和氢氧化钠溶液D. NH4Cl晶体和Ba(OH)28H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 合成氨生产中,使用高效催化剂可提高原料平衡转化率
B. 铁质管道与锌用导线相连(如图所示)可防止管道被腐蚀

C. 5 mL 18 mol·L-1浓硫酸与足量铜共热,反应最多转移0.18 mol电子
D. 常温下,反应2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,该反应ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的Q、W、X、Y、Z五种元素中,Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,W与Y同主族、X和Y同周期;X是地壳中含量最高的金属元素、Z存在胆矾之中。下列关于它们的叙述合理的是
A. 最高价氧化物对应水化物的酸性比X比Z强
B. W与X简单离子半径后者更大
C. W、Y两种元素最高化合价相同
D. X、Z两种金属在两千多年前就被我们祖先广泛使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com