
【题目】下列四种情况的变化中,反应速率最快的是( )
A. 溶洞形成B. 火药爆炸C. 牛奶变质D. 铁桥生锈
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
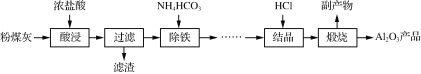
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。

(4)上述流程中,可以循环利用的物质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=________。
②已知H2C2O4是二元弱酸。室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,KHC2O4水解平衡常数的数值为____。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.770 0 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.090 0 g。
步骤Ⅱ 准确称取1.770 0 g样品,用NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.050 00 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
消耗EDTA标准溶液 的体积/mL | 25.92 | 24.99 | 25.01 |
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有____(填字母)。
A. 锥形瓶水洗后未干燥
B. 滴定时锥形瓶中有液体溅出
C. 装EDTA标准溶液的滴定管水洗后未润洗
D. 开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(2)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.Vd/(MV+2240) B.1000Vd/(MV+2240) C.1000VdM/(MV+2240) D.MV/22.4(V+0.1)d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14%的KNO3溶液与30.0g质量分数为24%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算:
(1)混合后溶液中KNO3的质量分数为____,物质的量浓度为_____。
(2)在1000g水中需溶解____molKNO3才能使其浓度恰好与上述混合溶液的浓度相等。
(3)标准状况下44.8LHCl溶于水配成500mL溶液。则其浓度为_____,100mL该溶液与足量NaHCO3反应,生成气体在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1
A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a)
C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L。回答下列问题:

(1)该混合气体的平均摩尔质量为______。
(2)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体的相对分子质量为______。
②气球中收集到的气体中,电子总数为______(用NA表示阿伏伽德罗常数的值)
③气球的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com