
有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道全满或半满。
(1)写出四种元素的元素符号:
A ;B ;C ;D 。
(2)写出C、D两种元素基态原子的轨道表示式:
C ;
D 。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:
。
(4)写出B元素单质和氢化物的电子式,单质 ,氢化物 。
科目:高中化学 来源: 题型:填空题
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074 nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的化合物Z2X2的一种用途: 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。原因是(用离子方程式表示)
(4)若将V金属投入到盐酸中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D 4种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应水化物是已知无机含氧酸中最强的酸。则:
(1)A、B、C、D分别是 、 、 、
(2)A的离子结构示意图为 ,C的原子结构示意图为
(3)C的最高价氧化物对应水化物与A的氢氧化物反应生成 种盐,其化学式为 、 、 (可不填满,也可补充)
(4)C、D的气态氢化物稳定性由强到弱的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)请写出A的元素符号 ;
(2)C的一价阴离子的结构示意图 ;
B的原子的结构示意图 ;
(3)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是( )。
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据报道,某些花岗岩会产生放射性的氡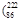 Rn),从而对人体产生伤害。请回答:
Rn),从而对人体产生伤害。请回答:
(1)该原子的质量数是 ,质子数是 ,中子数是 。
(2)请将以下Rn的原子结构示意图补全。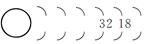
(3)请根据Rn的原子结构预测氡气的化学性质:
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼,与氮气性质相似
D.很难与其他物质发生反应
你选择 选项,理由是 。
(4)研究发现,镭能衰变为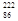 Rn,故称
Rn,故称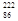 Rn为镭射气;钍能衰变为
Rn为镭射气;钍能衰变为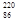 Rn,故将
Rn,故将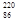 Rn称为钍射气;锕能衰变为
Rn称为钍射气;锕能衰变为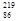 Rn,故将
Rn,故将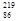 Rn称为锕射气
Rn称为锕射气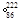 Rn
Rn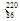 Rn
Rn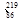 Rn是 (填字母序号)。
Rn是 (填字母序号)。
A.同种元素 B.同位素
C.同种核素 D.同种原子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4:1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2:1反应形成盐丙。
(1)甲的电子式是 。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是 。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为________;工业生产该化合物和单质F的离子方程式为_________________________________________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为_________________________________________________________________________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为____________。
0.1 mol·L-1该化合物水溶液中的离子浓度由大到小的顺序为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有甲、乙、丙三种短周期元素,甲元素原子的质子数比中子数小2,乙元素原子核内无中子,丙元素质子数与甲元素质量数相等,且甲与丙同主族。
(1)甲、乙、丙元素的元素符号分别是________、________、________。
(2)甲与乙、丙与乙所形成的化合物稳定性强的是____________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com