
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式为___________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2mL此溶液于3支试管中,进行实验:能证明水合草酸亚铁中存在Fe2+的试剂有______(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。

实验步骤如下:
a.打开K1和K2,缓缓通入N2;
b.低温加热装置A一段时间;
c.停上加热,冷却到室温;
d.关闭K1和K2,称量A;
e._______________,记为m3g。
①补充实验步骤e为____________________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是______________________________________。
③根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=________(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
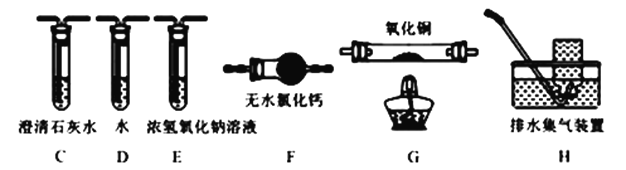
①实验装置中,依次连接的合理顺序为A→___________________________。
②证明产物有CO生成的现象是__________________________________。
③写出草酸亚铁受热分解的化学方程式为_________________________________。
【答案】 FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4 B 重复上述a~d步骤,直至A恒重 将装置A中的水蒸气带走;同时防止FeC2O4被空气氧化 [8(m2-m3)]/(m3-m1) C→E→C→F→G→C→H G装置黑色固体变红,其后的C中澄清石灰水变浑浊 3FeC2O4![]() Fe3O4+4CO↑+2CO2↑
Fe3O4+4CO↑+2CO2↑
【解析】(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,水合草酸亚铁为FeC2O4xH2O,反应还产生H2SO4,所以反应的方程式为:FeSO4+H2C2O4+xH2O═FeC2O4xH2O↓+H2SO4,故答案为:FeSO4+H2C2O4+xH2O═FeC2O4xH2O↓+H2SO4;
(2)A.KSCN溶液与亚铁离子反应没有明显的现象,不能检验,错误;B.K3[Fe(CN)6]溶液与亚铁离子反应生成蓝色沉淀,正确;C.酸性KMnO4溶液能够被亚铁离子和草酸根离子还原褪色,不能说明含有亚铁离子,错误;故选B;
(3)①实验步骤为:a.打开K1和K2,缓缓通入N2;b.低温加热装置A一段时间;c.停上加热,冷却到室温;d.关闭K1和K2,称量A;e. 重复上述a~d步骤,直至A恒重,记为m3g,故答案为:重复上述a~d步骤,直至A恒重;
②反应过程中通入N2,N2不参加反应,作为保护气,加热装置A一段时间到停止加热段内通入N2,考虑到实验目的是测定水合草酸亚铁中结晶水含量,所以通入N2有两个目的,一是赶出H2O,二是防止FeC2O4被氧化,故答案为:将装置A中的水蒸气带走,同时防止FeC2O4冷却时被氧化;
③装置质量为m1g,装入样品后质量为m2g,则样品质量为(m2-m1)g,加热一段时间停止加热,称量质量,重复操作直至质量不变,说明此时结晶水完全失去,则热解产物FeC2O4的质量为(m3-m1)g,所以结晶水的质量为(m2-m3)g,
FeC2O4~~~~~~xH2O
144 18x
(m3-m1)g (m2-m3)g
则有![]() =
=![]() ,可得x=
,可得x=![]() ,故答案为:
,故答案为:![]() ;
;
(4)①加热分解FeC2O4产生CO2和CO,则实验装置需要验证CO2和CO,验证CO2使用澄清石灰水,验证CO可用能够还原CuO的性质,所以连接装置为:从A开始,连接C装置验证CO2,然后使用浓NaOH充分吸收CO2,此时可再次连接C装置看有无CO2残留,然后进行干燥气体处理,连接装置F吸收H2O,然后连接装置G验证CO,CO还原CuO为Cu,自身转化为CO2,这里可用装置C处理CO2,若澄清石灰水变浑浊可进一步验证CO,最后处理尾气CO,用装置H排水法收集尾气,故答案为:C→E→C→F→G→C→H。
②一氧化碳可以还原氧化铜,证明产物有CO生成的现象是G装置黑色固体变红,其后的C中澄清石灰水变浑浊,故答案为:G装置黑色固体变红,其后的C中澄清石灰水变浑浊;
③实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物,应为Fe3O4,同时产生CO2和CO,所以FeC2O4加热分解的化学方程式为:3FeC2O4═Fe3O4+4CO↑+2CO2↑,故答案为:3FeC2O4═Fe3O4+4CO↑+2CO2↑。


科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Kb(NH3·H2O)=1.76×10-5。25℃时,分别向浓度均为0.1mol/L,体积均为20mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c水(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX==H++X-
B. b点时溶液中c(NH4+)=c(Y-)>c(H+)=c(OH-)
C. 其中一种酸的电离度为0.1%
D. a点溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金有许多特点,如NaK合金为液体,而Na和K的单质均为固体。据此推测:青铜(CuSn合金)、铜和锡三种物质中,熔点最低的是
A. 铜 B. 锡 C. 青铜 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温下H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是

A. 升高温度
B. 增大压强
C. 增大反应物浓度
D. 加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子的中子数为( )
A.118
B.175
C.47
D.293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是
A. 往容积一定的容器中再通入O2,可以加快反应2SO2+O2![]() 2SO3的反应速率
2SO3的反应速率
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 对于C(s)+H2O(g)![]() CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com