
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。
【答案】
(1)1:3,1:1,小于
(2)增大,不变,增大
(3)逆向
(4)向左移动,小于
【解析】解:(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率之比都等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1。
所以答案是:1:3;1:1。
(2)该反应是放热反应,所以降温,平衡正向移动,气体物质的量减小,但根据质量守恒定律,质量不变,气体的平均相对分子质量=气体质量总和除以气体物质的量总和,所以,混合气体的平均相对分子质量增大;因容器体积没变,气体质量不变,所以密度不变;因K只与温度有关,降低温度,平衡正向移动,则生成物浓度增加、反应物浓度减小,根据平衡常数的定义可知,K增大。
所以答案是:增大;不变;增大。
(3)充入氩气并保持压强不变,体积变大,相关气体的分压变小,平衡向体积增大的逆向移动。
所以答案是:逆向。
(4)升温,平衡向吸热的逆向移动,使体系温度降低。
所以答案是:向左移动;小于。


科目:高中化学 来源: 题型:
【题目】将相同的锌片和铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生 B. 两烧杯中溶液的H+浓度都减小
C. 产生气泡的速率甲比乙慢 D. 甲中铜片是正极,乙中铜片是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲~丁是四种有机物分子的球棍模型。

(1)甲分子的空间构型是____,乙的电子式为_____。
(2)丙与丁反应的化学方程式________。
下图是用燃烧法来确定有机物组成的常用装置。其方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量来确定有机物的组成。
已知:装置C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳,A中的反应为2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。

(3)A装置中b仪器的名称________,盛放的物质是________(填化学式)。
(4)若无B装置会对_____元素的测量结果有影响(填元素符号)。
(5)E装置中所盛放物质最好选用____(选填:①氢氧化钙溶液;②氢氧化钠溶液;③水)。
(6)若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种)。经充分燃烧后继续通入氧气一会儿,冷却,称量,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物N是合成药物洛索洛芬钠(治疗关节炎)的重要中间体,其合成路线如下:

已知:(R、R1、R2均为烃基)
①RCN ![]() RCOOH;②R1CH=CHR2
RCOOH;②R1CH=CHR2 ![]() R1COOH + R2 COOH
R1COOH + R2 COOH
回答下列问题:
(1)①已知烃A的核磁共振氢谱中只有一组峰,A的名称是________。
②N分子中的官能团名称是________。
(2)D→F的反应类型是________。C→E的反应条件是___________。
(3)①写出B与Cl2按物质的量1:1发生反应时主要副产物的结构简式_________。
②合成路线A→G比B→G更优,除副产物少外,还有______和_________的优点。
(4)写出G→M的化学方程式__________________。
(5)写出满足下列条件的H的一种同分异构体的结构简式___________。
①只含有一种官能团;②酸性条件下水解产物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g) ![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数减小了
D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):

已知:Ⅰ. 
Ⅱ. 
回答下列问题:
(1)B的名称是____________________。
(2)反应②和⑤所属的反应类型分别为____________、_____________。
(3)反应④所需的条件为___________,E分子中官能团的名称为_________________。
(4)反应⑥的化学方程式为________________________________。
(5)芳香族化合物X是C的同分异构体,X只含一种官能团且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,则X的结构有__________种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3 :2 : 2 :1的结构简式为____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)═CO2(g)△H1 C(s)+ ![]() O2(g)═CO(g)△H2 , 则△H2>△H1
O2(g)═CO(g)△H2 , 则△H2>△H1
C.已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式为___________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2mL此溶液于3支试管中,进行实验:能证明水合草酸亚铁中存在Fe2+的试剂有______(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。

实验步骤如下:
a.打开K1和K2,缓缓通入N2;
b.低温加热装置A一段时间;
c.停上加热,冷却到室温;
d.关闭K1和K2,称量A;
e._______________,记为m3g。
①补充实验步骤e为____________________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是______________________________________。
③根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=________(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
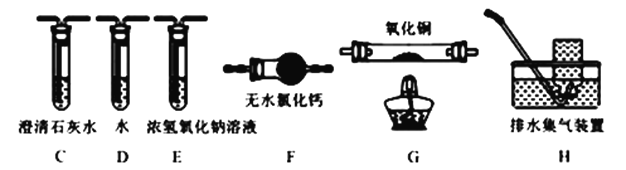
①实验装置中,依次连接的合理顺序为A→___________________________。
②证明产物有CO生成的现象是__________________________________。
③写出草酸亚铁受热分解的化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com