
【题目】已知NaHSO3溶液呈弱酸性。在0.1mol/L NaHSO3溶液中,下列粒子浓度关系式不正确的是( )
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2SO3)
)>c(H2SO3)
B.c(H+)+c(![]() )=c(OH-)+c(H2SO3)
)=c(OH-)+c(H2SO3)
C.c(Na+)=c(![]() )+c(H2SO3)+c(
)+c(H2SO3)+c(![]() )
)
D.c(H+)+c(Na+) =c(OH-)+c(![]() )+2c(
)+2c(![]() )
)
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧氧化管内样品,根据产物质量确定有机物的组成,装置如下图所示,是用燃烧法确定有机物化学式常用的装置。产生的氧气按从左到右流向各导管的连接顺序为g-f,e-h , i-c , d-a。

回答下列问题:
(1)C装置中浓H2SO4的作用______________________________________。
(2)D装置中MnO2的作用为________________________。
(3)E中CuO的作用为_____________________。
(4)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物最简式为______________,若此有机物的相对分子质量为90,则其分子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,向体积均为20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ溶液中分别逐滴加入0.1000mol·L-1的NaOH溶液,所得溶液的pH与加入NaOH溶液的体积关系如图所示。下列说法正确的是( )
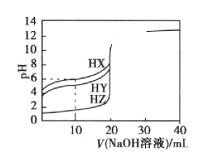
A.当V(NaOH溶液)=0mL时,三种溶液相比较c(X-)>c(Y-)>c(Z-)
B.当三种溶液pH均等于7时,反应消耗的n(HX)>n(HY)>n(HZ)
C.当V(NaOH溶液)=10mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+)
D.HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50molL-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
实验步骤 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2L的恒容密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A.乙容器中,平衡时,反应放出的热量为32.8kJB.T1时,反应的平衡常数K乙=1
C.平衡时,乙中CO的浓度是甲中的2倍D.乙容器中,平衡时H2O的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(R)的合成路线如下:
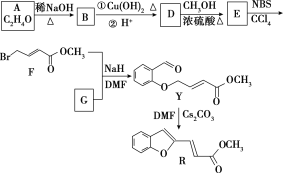
已知:RCHO+R1CH2CHO![]()
![]() +H2O(R、R1表示烃基或氢)
+H2O(R、R1表示烃基或氢)
(1)①A的名称是________。
②D―→E的反应类型是________。
③F中含有的官能团有酯基、________和________(写名称)。
④写出F与足量NaOH溶液共热反应的化学方程式___________。
(2)物质G可通过如下流程合成:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
1.08 g的I与饱和溴水完全反应,生成2.66 g白色沉淀,则I的结构简式为_________写出M―→G中反应①的化学方程式______________________。
(3)下列说法正确的是________(选填字母)。
a.Y易溶于水
b.B能使酸性高锰酸钾溶液褪色
c.R的分子式为C12H10O3
d.I与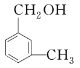 互为同系物
互为同系物
(4)写出符合下列要求的E的同分异构体的结构简式:____(写反式结构)。
①与E具有相同官能团 ②能发生银镜反应 ③有2个-CH3 ④存在顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______(填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,__________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应______________(写离子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com