
【题目】下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为____________
(2)⑦的黄绿色单质的化学式为____________⑩的单质在常温下的存在状态为____________
(3)①的气态氢化物的水溶液显_______
(4)用电子式表示②与④形成化合物的过程______
(5)这些元素中的最高价氧化物对应的水化物中,碱性最强的是__呈两性的是__
(6)写出⑤与盐酸反应的化学方程式:__________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:______
【答案】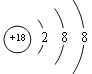 Cl2 液体 碱 Si
Cl2 液体 碱 Si ![]() KOH Al (OH)3 2Al+6HCl=2AlCl3+3H2↑ Al (OH)3+OH-=AlO2-+2H2O
KOH Al (OH)3 2Al+6HCl=2AlCl3+3H2↑ Al (OH)3+OH-=AlO2-+2H2O
【解析】
由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br。
(1)以上元素中只有Ar的最外层电子数为8,性质不活泼,最稳定,其原子结构示意图为: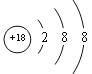 ;
;
(2)由分析可知⑦为Cl,其黄绿色单质的化学式为Cl2;⑩为Br,其单质Br2在常温下的存在状态为:液态;
(3)①为N,其氢化物为NH3,溶于水生成一水合铵,一水合铵电离出氢氧根离子,溶液显碱性;⑥的元素符号为Si;
(4)②与④形成的化合物为MgF2,为离子化合物,其电子式为,所以MgF2的形成过程是:![]() ;
;
(5)以上元素中最高价氧化物对应的水化物中碱性最强的为KOH,呈两性的氢氧化物为Al(OH)3;
(6)⑤为Al,与盐酸反应生成氯化铝和氢气,方程式为:2Al+6HCl=2AlCl3+3H2↑;⑤的氢氧化物为Al (OH)3,与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al (OH)3+OH-=AlO2-+2H2O。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、二氧化碳、氧气作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”(碱式碳酸铜),“铜绿”能跟酸反应生成铜盐、二氧化碳和水。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于物质的类别是____。
(2)请写出铜绿与盐酸反应的化学方程式_____。
(3)写出B的化学式_____。
(4)上述转化过程中属于化合反应的是___,属于复分解反应的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是

A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5 mol·L—1
D. 参加反应铁粉的总质量m2=5.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极![]() 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加![]() 据此回答问题:
据此回答问题:
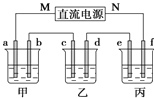
(1)电源的M端为_____________极;
(2)电极d上发生的电极反应式为__________; 乙池溶液PH__________填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________;
(5)若利用丙池实现铁上镀铜,则“e-f-x”![]() 溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯![]() 结构式为
结构式为![]() 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由![]() 和
和![]() 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为![]() 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
化学键 |
|
|
|
|
键能 | 243 | a | 607 | 630 |
当![]() 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
C.无色溶液中一定大量存在Al3+、NH4+、Cl-、S2-
D.![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B. CH2===CH2+HCl―→CH3CH2Cl
C. CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
D. 2CH3CH3+7O2![]() 4CO2+6H2O
4CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.质量为16g的O2和O3的混合气体中所含的氧原子的个数为NA
B.18 g NH4+含有质子数为10NA
C.1 mol过氧化钠与足量水反应时,转移电子的数目为2NA
D.0.1 molL﹣1的NaCl溶液中,Na+与Cl﹣的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol·L-1、0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol·L-1)是( )
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.![]()
II.![]()
(1)则![]() 的△H= ________(用△H1、△H2表示)
的△H= ________(用△H1、△H2表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(3)在恒容密闭容器中发生反应I:

①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=________,反应I的平衡常数K=________。
②反应II中CH3OH的转化率α=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com