
【题目】本题为《化学反应原理(选修4)》选做题。
(l)T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C的浓度随时间t的变化如图所示。

该反应的化学方程式为____________。在2分钟内用A的浓度变化表示的平均反应速率为___________mol·L一l·min一l。
(2)一定条件下,上述反应达到化学平衡状态的标志是_____(填字母代号)。
A.v(正)=v(逆)=0
B.各物质的浓度不再变化
C.单位时间内消耗1molA,同时生成3molB
(3)若该反应放出热量,升高温度时,化学反应速率______(填“增大”或“减小”),平衡向______(填“正”或“逆”)反应方向移动。
(4)下图是电解NaCl溶液的示意图。请回答下列问题:
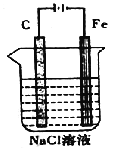
① 石墨电极上的反应式为_____________;
② 电解一段时间后,溶液的pH______(填“增大”“减小”或“不变”)。
(5)水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
① 常温下,0.1mol/LNH4Cl溶液呈______(填“酸”“碱”或“中”)性,溶液中c(NH4+)____c(Cl-)(填“>”“< ”或“=”);
② 已知:20℃时,Ksp(AgCl)=1.1×10-10, Ksp(AgBr)=2.0×10-13。在浓度均为0.01mol/L的NaCl和NaBr混合溶液中,逐滴加入AgNO3溶液,先产生的沉淀是_____(填“AgCl”或“AgBr ”)。
【答案】 3A(g)+B(g)![]() 2C(g) 1.5 B 增大 逆 2Cl--2e-=Cl2↑ 增大 酸 < AgBr
2C(g) 1.5 B 增大 逆 2Cl--2e-=Cl2↑ 增大 酸 < AgBr
【解析】(1)考查化学反应速率的计算,A和B物质的量浓度降低,说明作反应物,C物质的量浓度增大,说明生成物,在2min时达到平衡,说明是可逆反应反应,系数比等于物质的量浓度变化比,即为(6-3):(4-3):2=3:1:2,反应方程式为:3A(g)+B(g)![]() 2C(g);根据化学反应速率的数学表达式,v(A)=(6-3)/2mol/(L·min)=1.5 mol/(L·min);(2)考查判断达到化学平衡状态,A、化学平衡是动态平衡,v(正)=v(逆)≠0,故A错误;B、根据化学平衡状态的定义,各组分的浓度不再改变,说明反应达到平衡,故B正确;C、用不同种物质表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,消耗A,说明反应向正反应方向进行,生成B反应向逆反应方向进行,但消耗1molA,生成3molB,与化学计量数不成比例,不能说明反应达到平衡,故C错误;(3)考查影响化学反应速率的因素和化学平衡移动的因素,升高温度,化学反应速率增大;该反应是放热反应,升高温度,平衡向逆反应方向移动;(4)考查电解原理,①石墨连接电源的正极,因此电极反应式为2Cl-2e-=Cl2↑;②电解总反应是2NaCl+2H2O=2NaOH+H2↑+Cl2↑,溶液pH增大;(5)考查溶液酸碱性、离子浓度大小比较、溶度积,①NH4Cl属于强酸弱碱盐,溶液显酸性,因为NH4+发生水解,因此c(NH4+)<c(Cl-);②同等形式时,相同浓度条件下,溶度积越小,首先作为沉淀沉降出来,因此先产生沉淀的是AgBr。
2C(g);根据化学反应速率的数学表达式,v(A)=(6-3)/2mol/(L·min)=1.5 mol/(L·min);(2)考查判断达到化学平衡状态,A、化学平衡是动态平衡,v(正)=v(逆)≠0,故A错误;B、根据化学平衡状态的定义,各组分的浓度不再改变,说明反应达到平衡,故B正确;C、用不同种物质表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,消耗A,说明反应向正反应方向进行,生成B反应向逆反应方向进行,但消耗1molA,生成3molB,与化学计量数不成比例,不能说明反应达到平衡,故C错误;(3)考查影响化学反应速率的因素和化学平衡移动的因素,升高温度,化学反应速率增大;该反应是放热反应,升高温度,平衡向逆反应方向移动;(4)考查电解原理,①石墨连接电源的正极,因此电极反应式为2Cl-2e-=Cl2↑;②电解总反应是2NaCl+2H2O=2NaOH+H2↑+Cl2↑,溶液pH增大;(5)考查溶液酸碱性、离子浓度大小比较、溶度积,①NH4Cl属于强酸弱碱盐,溶液显酸性,因为NH4+发生水解,因此c(NH4+)<c(Cl-);②同等形式时,相同浓度条件下,溶度积越小,首先作为沉淀沉降出来,因此先产生沉淀的是AgBr。


科目:高中化学 来源: 题型:
【题目】高分子材料M在光聚合物和金属涂料方面有重要用途,已知
①磷酸的结构简式为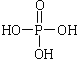
②M的结构简式为: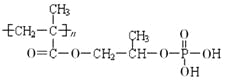
工业上合成M的过程可表示如下:
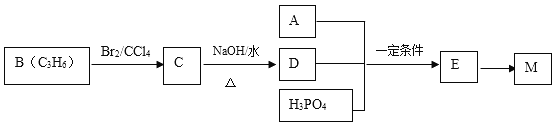
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填字母序号)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D易溶于水
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式(反应物均用结构简式表示): ,该反应类型是 反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。F存在下列转化关系:
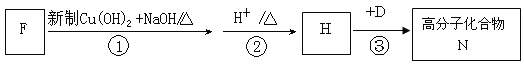
写出F、N的结构简式F: ,N: 。
写出反应①的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)铝灰中氧化铝与硫酸反应的化学方程式为____________________________________。
(2)加30%的H2O2溶液的目的是_________________________________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体为___________(填化学式)。
②KMnO4溶液褪色(MnO4-还原为Mn2+),此褪色过程中,氧化剂与还原剂的物质的量之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用KNO3的性质是( )
A. 自燃性 B. 稳定性 C. 还原性 D. 氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙烯和乙醇都能发生加成反应
B. 乙酸和四氯化碳都可萃取溴水中的Br2
C. 苯和四氟乙烯分子中的所有原子均处于同一平面
D. 糖类、油脂及蛋白质均只由碳、氢、氧三种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、4 mol·L-1硫酸溶液,其他试剂任选。填写下列空白:
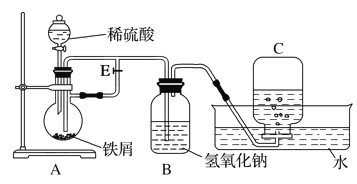
(1)实验开始时应先将活塞E________(填“打开”或“关闭”)。
(2)在该实验中生成的Fe(OH)2白色沉淀可保持较长时间,可能的原因为_______________________________。
(3)拔去装置B中的橡皮塞,使空气进入,写出Fe(OH)2被氧化的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1mol·L-1盐酸滴入20mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。下列有关说法不正确的是( )
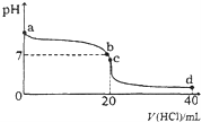
A. a点的pH>7,但Kw仍为1.0×1014
B. b点所示溶液中c(Cl)=c(NH4+)
C. C点溶液pH<7,其原因是NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
D. d点所示溶液中离子浓度由大到小的排序是:c(Cl)>c(NH4+)>c(H+)>c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com