
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示
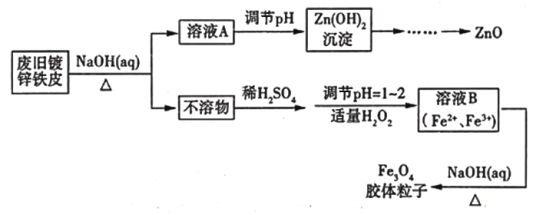
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是_______________________。
(2)向不溶物中加入稀硫酸发生反应的离子方程式是____________________________________。
(3)加入适量H2O2的目的是__________________________________。
(4)如何证明已生成了Fe3O4胶体?_____________________________________________________。
(5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为__________________mol/L。
(6)稀硫酸也可以用浓硫酸和水配制。已知4 mol/L的硫酸溶液密度为ρ1g/cm3,2 mol/L的硫酸溶液密度为ρ2g/cm3。100g物质的量浓度为4 mol/L的硫酸溶液与___________mL水混合,使硫酸的物质的量浓度减小到2 mol/L(用含ρ1、ρ2的式子表示)
【答案】Zn 2H++Fe=Fe2++H2↑ 做氧化剂,将部分Fe2+氧化为Fe3+ 利用丁达尔效应 1.25 ![]()
【解析】
废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,将部分亚铁离子氧化为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子。
(1)从流程图可以看出,锌能溶于氢氧化钠溶液,则加入氢氧化钠,锌发生反应,故答案为:Zn;
(2)不溶物为Fe,加入硫酸反应生成硫酸亚铁,反应的离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(3)在酸性条件下,H2O2能将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:做氧化剂,将部分Fe2+氧化为Fe3+;
(4)胶体具有丁达尔效应,可用丁达尔效应检验胶体的生成,故答案为:利用丁达尔效应;
(5)n(H2SO4)=2n(H2SO4SO3)=![]() ×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=
×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=![]() =1.25mol/L,故答案为:1.25;
=1.25mol/L,故答案为:1.25;
(6)设所需要水的体积为VmL,则稀释后溶液的浓度2mol/L=![]() =
=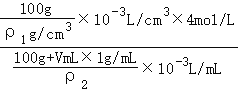 ,解得:V=
,解得:V=![]() mL,故答案为:
mL,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全)。下列关于整个反应进程中的各种描述不正确的是
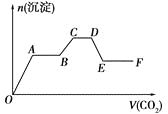
A.A→B段与C→D段所发生的反应相同
B.B→C段反应的离子方程式是:2AlO2―+3H2O+CO2=2Al(OH)3↓+CO32―
C.O→A段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.D→E段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:

①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。______
③写出修改后石墨电极的电极反应式______。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:

①A电极对应的金属是__(写元素名称),B电极的电极反应式是____。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为___ mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物的结构简式如图所示: ![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)。下列说法正确的是
(c)。下列说法正确的是
A. 三种物质中只有a、b互为同分异构体
B. a、b、c分别有3种、4种、5种不同化学环境的氢原子
C. a、b、c均能发生氧化反应、取代反应、加成反应
D. c分子内至少有6个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
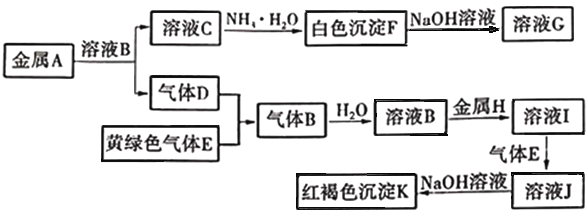
(1)写出下列物质的化学式:B是_________________, F是_________________,K是_________________。
(2)写出反应 “A→C”的离子方程式:_________________________________________。
(3)写出反应 “I→J”的化学方程式:_________________________________________。
(4)在溶液中滴加NaOH溶液,可观察到的现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com