
【题目】某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
(1)该反应的氧化剂是____________。
(2)在该反应中,发生氧化反应的过程是___________→___________。
(3)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:_____________。
(4)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为___________。
【答案】Fe2(SO4)3 SnC12 SnC14 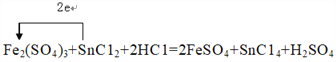 1:2
1:2
【解析】
反应的总方程式:Fe2(SO4)3+SnCl2+2HCl=2FeSO4+SnCl4+H2SO4,
(1)反应前后Fe元素化合价降低,Fe2(SO4)3作氧化剂;
(2)Sn元素化合价升高,SnC12被氧化生成 SnC14,则发生氧化反应的过程是SnC12→SnC14;
(3)该反应为Fe2(SO4)3+SnCl2+2HCl=2FeSO4+SnCl4+H2SO4,反应中SnCl2被氧化成SnCl4,化合价升高2价,故转移的电子数目为2,电子从还原剂移向氧化剂,电子转移的方向和数目可表示为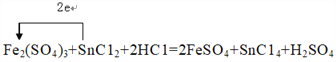 ;
;
(4)HgC12与SnC12反应的产物是SnC14和Hg2C12,Sn元素化合价由+2价升高到+4价,Hg元素化合价由+2价降低到+1价,则还原剂与氧化剂的物质的量之比为1:2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol·L-1的CH3COOH溶液,pH变化曲线如图所示:
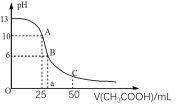
(1)该氢氧化钠溶液的物质的量浓度为__。
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:__。
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:______。
(4)B点所示溶液中,![]() =___。
=___。
(5)C点所示溶液为等浓度的CH3COONa和CH3COOH混合溶液,请判断该溶液中c(CH3COOH)__c(CH3COO-)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示,与氢气发生加成反应得到物质甲,下列有关说法不正确的是

A.有机物M含有2种官能团
B.有机物M的分子式为C4H6O2
C.有机物M能发生取代反应、加聚反应
D.甲只含有一种官能团的链状同分异构体(不含甲本身)有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
![]() 【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
![]()
![]() A.
A.![]() B.
B.![]() 和
和![]()
C.![]() 和
和![]() D.
D. ![]() 和FeO
和FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.95℃纯水显中性,故pH=7
B.稀释弱电解质溶液时,溶液中所有粒子浓度都减小
C.pH试纸在使用之前应用蒸馏水润湿
D.室温下,向10 mL pH=3的醋酸溶液中加水稀释后,溶液中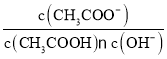 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素.

(1)常温下,其单质呈液态的元素是____(填字母代号),它与e形成的化合物电子式为:_____(用元素符号表示)
b元素形成的单质所属品体类型可能是____(填序号)
①分子晶体 ②原子晶体 ③金属晶体 ④离子晶体 ⑤过渡型晶体
(2)元素c、d、g的氢化物的沸点由高到低的顺序为______(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、Q原子序数依次增大,Y元素最外层电子数是其电子层数的3倍,Q与Y同主族,X与Y构成的化合物可引起光化学烟雾,Z、W、Q的最高价氧化物的水化物两两之间均能发生反应。下列说法正确的是( )
A.简单氢化物的沸点:Y<QB.W的氧化物可作耐高温材料
C.简单离子半径最大的为ZD.气态氢化物的稳定性:Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
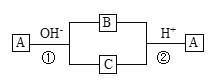
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com