
【题目】下列说法正确的是( )
A.95℃纯水显中性,故pH=7
B.稀释弱电解质溶液时,溶液中所有粒子浓度都减小
C.pH试纸在使用之前应用蒸馏水润湿
D.室温下,向10 mL pH=3的醋酸溶液中加水稀释后,溶液中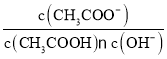 的值不变
的值不变
【答案】D
【解析】
A. 水是弱电解质,电离吸收热量,升高温度水电离程度增大,溶液中c(H+)增大,溶液pH减小,所以95℃纯水显中性,故pH<7,A错误;
B. 稀释弱酸溶液时,溶液中c(H+)减小,溶液中c(OH-)增大;稀释弱碱溶液时,溶液中c(OH-)减小,溶液中c(H+)增大;因此稀释弱电解质溶液时,不是所有粒子浓度都减小,B错误;
C. pH试纸在使用之前不能蒸馏水润湿,否则会对溶液起稀释作用,会造成测量误差,C错误;
D. 室温下,向10 mL pH=3的醋酸溶液中加水稀释后,溶液中c(CH3COO-)、c(CH3COOH)、c(H+)都减小,但电离平衡正向移动,所以c(CH3COOH)减小的倍数大于c(CH3COO-)和c(H+)减小的倍数,溶液中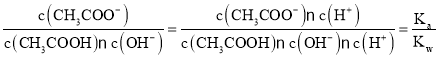 ,温度不变,Ka、Kw不变,所以
,温度不变,Ka、Kw不变,所以![]() 的值不变,D正确;
的值不变,D正确;
故答案选D。


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl—+HClO
H++Cl—+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-= AgCl↓
A.①②③④⑤B.①②③C.②③D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,某同学做了如下实验:
①将2.3 g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得图所示的质谱图;

③用核磁共振仪处理该化合物,得图所示图谱,图中三个峰的面积之比是1∶2∶3。

试回答下列问题:
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
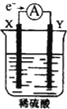
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
(1)该反应的氧化剂是____________。
(2)在该反应中,发生氧化反应的过程是___________→___________。
(3)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:_____________。
(4)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
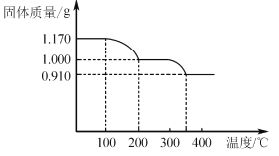
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
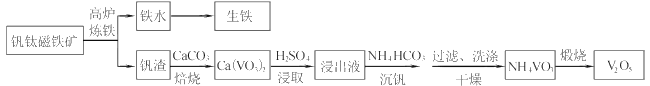
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。合成路线如下:

完成下列填空:
(1)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏,且反应过程中96%的硫转化为石膏,则可生产石膏______ t。
(2)操作a中,必须的操作步骤有蒸发、___________、___________等;
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________;
(4)写出反应Ⅳ的方程式______________ ;操作b所得滤液中阳离子的检验方法是________________。
(5)反应Ⅴ在25℃,40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是___________;
(6)该生产过程中可以循环使用的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应是放热反应
B. 该反应的ΔH=-(E1-E2) kJ· mol-1
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com