
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
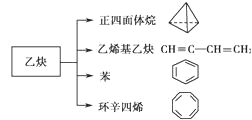
下列说法正确的是( )
A.1mol乙烯基乙炔能与 3mol Br2发生加成反应
B.正四面体烷二氯取代产物只有1种
C.环辛四烯核磁共振氢谱有2组峰
D.环辛四烯与苯互为同系物
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是

A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)连氨(N2H4)常温下为液态,在空气中迅速完成燃烧生成N2,同时放出大量热,可作导弹、宇航飞船、火箭的燃料。
已知:H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
N2(g)+2H2(g)═N2H4(l)△H2=+50.6kJmol-1
则N2H4(l)在空气燃烧生成液态水的热化学方程式为______。
(2)工业上利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0。一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为![]() 。0-4min内,用H2表示的该反应速率v(H2)=______。
。0-4min内,用H2表示的该反应速率v(H2)=______。
保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正______v逆(选填“>”“<”或“=”)。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),其平衡常数的表达式为K稳=______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=______。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
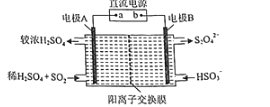
①电极A的电极反应式为______。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、碳、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式___。
(2)实验室用KSCN溶液、检验Fe3+。C、N、O的电负性由大到小的顺序为___(用元素符号表示),一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式___。
(3)FeCl3的熔点为306℃,沸点为315℃FeCl3的晶体类型是__。FeSO4常作补铁剂,SO42-的立体构型是__。
(4)CH3OH分子中O原子的杂化方式为___,键角:H-C-H___H-O-C。(填“<”、“>”、“=”)CH3OH能与H2O以任意比互溶的原因是___。
(5)已知C60分子结构和C60晶胞示意图(如图I、图Ⅱ所示):
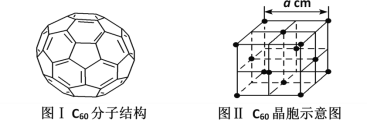
则一个C60分子中含有σ键的个数为__,与每个C60分子距离最近且相等的C60分子有__个,C60晶体的密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
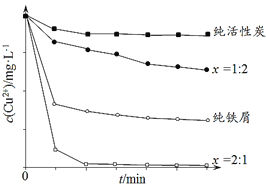
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题:
A.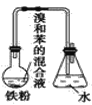 B.
B. 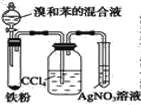 C.
C. 
(1)写出三个装置中所共同发生的主要反应的化学方程式:__________________。苯参与的反应的反应类型为________________
(2)装置 A 和 C 均采用了长玻璃导管,其作用是______________。
(3)在按装置 B 装好仪器及药品后要使反应开始,应对装置 B 进行的操作是_____________;分子式为 C8H10且属于苯的同系物的结构有_______________种。
(4)装置 B,C 较好地解决了 A 中加装药品和使装置及时密封的矛盾,方便了操作。A 装置中这一问题在实验中造成的后果是______________。
(5)B 中采用了洗气瓶吸收装置,其作用是_______________,反应后洗气瓶中可能出现的现象是_________________。
(6)B 装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=________________。
②已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-890.3kJmol-1,CO(g) + H2O(g) = CO2(g) + H2(g) △H=+2.8kJmol-1,2CO(g) + O2(g) = 2CO2(g) △H=-566.0kJmol-1,反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g)的△H=_______。
2CO(g) + 2H2(g)的△H=_______。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸。
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。
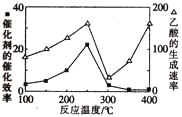
②为了提高该反应中CH4的转化率,可以采取的措施是__________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________。
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的。写出聚碳酸酯的结构简式:__________。
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.![]() =1×1014的溶液:NH4+、CrO42-、HS-
=1×1014的溶液:NH4+、CrO42-、HS-
B.含大量NO3-的溶液:Fe2+、SO42-、H+
C.水电离产生的c(OH-)=10-13 mol/L的溶液:Mg2+、Na+、Cl-
D.甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com