
| ||
| aL |
| 22.4L/mol |
| a |
| 22.4×5 |
| ||
| a |
| 22.4×5 |
| 2a |
| 22.4×5 |
| 2a |
| 22.4×5 |
| 2×24a |
| 22.4×5 |
| 3a |
| 7 |
| ||
| 3a |
| 7 |


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
| A、在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B、可用四氯化碳萃取溴水中的溴 |
| C、在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D、作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理量 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | |||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | |||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.010 | 4.0 | 25 | |||
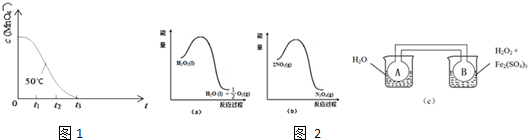
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯甲酸) | A.饱和Na2CO3溶液 B.溴水 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.洗气 d.过滤 | ① | ||
| ②乙醇(水) | ② | ||||
| ③乙烷(乙烯) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用完后的废电池应该集中回收处理 |
| B、天然果汁中不含任何化学物质 |
| C、“绿色食品”指颜色为绿色的食品 |
| D、“白色污染”是白色粉尘造成的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
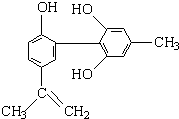 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是| A、①⑤⑥ | B、①④⑤ |
| C、①④⑥ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度下NaNO3的溶解度为200 g | ||
B、原不饱和溶液中NaNO3的质量分数为
| ||
C、原不饱和溶液中NaNO3的物质的量浓度为
| ||
D、原不饱和溶液的密度为
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com