
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯甲酸) | A.饱和Na2CO3溶液 B.溴水 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.洗气 d.过滤 | ① | ||
| ②乙醇(水) | ② | ||||
| ③乙烷(乙烯) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
| ① | C | b |
| ② | D | a |
| ③ | B | c |
| ④ | A | b |


科目:高中化学 来源: 题型:
| A、可以用酒精萃取出碘单质 |
| B、可以用CCl4萃取出碘单质,理由是CCl4密度比水大 |
| C、若用CCl4萃取出碘单质,萃取后下层液体呈紫红色 |
| D、若用CCl4萃取出碘单质,萃取后无色液体层应从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
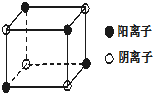 现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:
现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | A原子所处的周期数、族序数都与其原子序数相等 |
| B | L层s电子数比p电子数少l |
| C | 核外电子有8种不同的运动状态 |
| D | 第三周期中的半导体材科 |
| E | 最外层电子数比次外层电子数少2个电子 |
| F | 第四周期中未成对电子数最多 |
| G | G3+核外电子有3层且M层3d轨道电子半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 锌皮质量/g | 硫酸浓度/(mol?L-1) | 酸用量/mL | 溶解耗时/h | ZnSO4?7H2O产率 |
| 1 | 11.1 | 6 | 34 | >24 | 88.83 |
| 2 | 12.0 | 4 | 56 | 11 | 88.92 |
| 3 | 12.0 | 3 | 72 | 5 | 91.54 |
| 4 | 12.6 | 2 | 107 | >24 | 91.33 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PCl5为0.6mol |
| B、PCl3大于0.8mol |
| C、再次达平衡时PCl5的体积分数比原平衡减小 |
| D、再次达平衡时PCl5的转化率比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-) |
| B、某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7 |
| D、含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
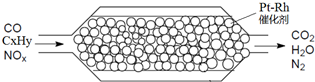
| A、NOX全部被过量CO还原为N2 |
| B、安装有该净化器的汽车可以使用含铅汽油 |
| C、催化剂涂在蜂窝状陶瓷上,可以提高反应速率 |
| D、当产生2.24L氮气时,转移的电子为4xmol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com