
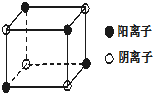
 现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:
现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | A原子所处的周期数、族序数都与其原子序数相等 |
| B | L层s电子数比p电子数少l |
| C | 核外电子有8种不同的运动状态 |
| D | 第三周期中的半导体材科 |
| E | 最外层电子数比次外层电子数少2个电子 |
| F | 第四周期中未成对电子数最多 |
| G | G3+核外电子有3层且M层3d轨道电子半充满 |
| 1 |
| 8 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
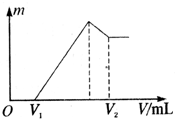 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CuO+H2
| ||||
B、C+2CuO
| ||||
C、Fe2O3+3CO2
| ||||
| D、Fe+CuSO4=FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯甲酸) | A.饱和Na2CO3溶液 B.溴水 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.洗气 d.过滤 | ① | ||
| ②乙醇(水) | ② | ||||
| ③乙烷(乙烯) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com